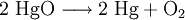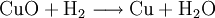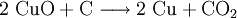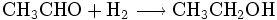- Desoxidation
-
Die Reduktion ist eine chemische Reaktionsart bei der Elektronen auf ein Molekül übertragen werden. Sie tritt zusammen mit der Oxidation auf.[1] Beide Phänomene laufen nie unabhängig voneinander ab und werden zusammen als Redoxreaktion bezeichnet. Ein Stoff, der bei einer Reaktion Elektronen abgibt, wird oxidiert, ein Stoff, der Elektronen aufnimmt, wird reduziert.
Inhaltsverzeichnis
Überholte Definitionen
Historisch bedingt gibt es mittlerweile veraltete Definitionen der Reduktion.
Abgabe von Sauerstoff
Im einfachsten Sinne ist eine Reduktion die Abgabe von Sauerstoff. Wenn z. B. rotes Quecksilberoxid in Quecksilber und Sauerstoff gespalten wird, so handelt es sich um eine Reduktion:
Ein zweites Beispiel: Wenn man Kupfer(II)-oxid (CuO) im Wasserstoffstrom erhitzt, so entsteht metallisches Kupfer (Cu), weil der Wasserstoff mit dem Sauerstoff des Kupfer(II)-oxid Wasser bildet; dem Kupfer(II)-oxid wird der Sauerstoff entzogen.
Ein drittes Beispiel: Wenn man Kupfer(II)-oxid zusammen mit Kohlenstoff (C) in einem Reagenzglas unter einem Gasbrenner erhitzt, erhält man Kupfer und Kohlenstoffdioxid (CO2). Das Kupfer(II)-oxid hat sich in Kupfer umgewandelt und der Sauerstoff ist nun im Kohlenstoffdioxid. (Das beim Versuch austretende Kohlenstoffdioxid lässt sich mit Kalkwasser nachweisen. siehe Kohlenstoffdioxid#Nachweis)
Aufnahme von Wasserstoff
Auf einer höheren Ebene definiert man Reduktion als Aufnahme von Wasserstoff (und Oxidation als Abgabe von Wasserstoff). Anmerkung: Auch hier werden Elektronen aufgenommen. Das heißt, es wird ein Proton sowie ein Elektron aufgenommen. Weil Wasserstoff jedoch wenig elektronegativ ist, zieht jedes andere Atom das Wasserstoffelektron zu sich hin, wenn es eine Verbindung mit „H“ eingeht. (Es ist also eher eine Aufnahme von Elektronen als eine Aufnahme von Wasserstoff) Wenn z. B. Acetaldehyd Wasserstoff aufnimmt, so entsteht Ethanol:
Dieser Reduktionsbegriff ist vor allem für biologische Vorgänge wichtig. In vielen Stoffwechselwegen einer Zelle findet eine Reduktion durch Übertragung von Wasserstoff statt. Die Zelle hat dafür sogar besondere Coenzyme entwickelt, z. B. NAD, NADP oder FAD, welche in der Lage sind, Wasserstoff von einer Verbindung auf eine andere zu übertragen.
Aktuelle Definition
Aufnahme von Elektronen / Verringerung der Oxidationszahl
Auf einer noch höheren Ebene schließlich wird unter Reduktion die Aufnahme von Elektronen verstanden. Wenn z. B. ein Eisennagel in eine Kupfersulfatlösung gestellt wird, bildet sich ein rotbrauner Belag von metallischem Kupfer auf dem Nagel, weil die Eisenatome Elektronen an die Kupferionen abgeben. Das Kupfer wird dabei reduziert (das Eisen oxidiert).
- Oxidation:
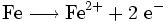
- Reduktion:
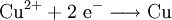
- Redoxgleichung:

Das Eisen, das während der Redoxreaktion selbst oxidiert wird, nennt man in diesem Zusammenhang auch Reduktionsmittel, weil seine Anwesenheit die Reduktion des Kupfers erst ermöglicht.
Reduktion bedeutet dabei immer ein Absinken der Oxidationszahl und damit Aufnahme von Elektronen. Oxidation bedeutet dagegen die Abgabe von Elektronen und somit eine Erhöhung der Oxidationszahl.
Einzelnachweise
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A.Wilkinson. Blackwell Scientific Publications, Oxford (1997). doi:10.1351/goldbook.R05222
Wikimedia Foundation.