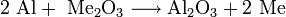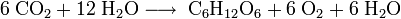- Redoxprozess
-
Eine Redoxreaktion (gesprochen: redóx; eigentlich: Reduktions-Oxidations-Reaktion) ist eine chemische Reaktion, bei der ein Reaktionspartner Elektronen auf den anderen überträgt. Bei einer solchen Elektronenübertragungs-Reaktion finden also eine Elektronenabgabe (Oxidation) durch einen Stoff sowie eine Elektronenaufnahme statt (Reduktion). Redoxreaktionen sind von grundlegender Bedeutung in der Chemie: Jeder Stoffwechsel- und Verbrennungsvorgang, viele technische Produktionsprozesse und viele Nachweisreaktionen basieren auf solchen Elektronenübertragungs-Reaktionen.
Bei jeder Redoxreaktion reagiert ein Stoff A, der Elektronen abgibt (Reduktionsmittel, Donator genannt) mit mindestens einem Stoff B, der diese Elektronen aufnimmt (Oxidationsmittel, Akzeptor). Die allgemeinen Reaktionsschemata lauten:
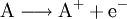
- Oxidation: Stoff A gibt als Reduktionsmittel ein Elektron ab.
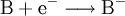
- Reduktion: Das Elektron wird vom Oxidationsmittel B aufgenommen.
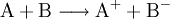
- Redoxreaktion: Stoff A gibt ein Elektron an Stoff B ab.
Zusammenfassung der beteiligten Vorgänge und Fachbegriffe Reduktion Elektronenaufnahme Oxidationsmittel + e- → Produkt Oxidationszahl wird kleiner Oxidation Elektronenabgabe Reduktionsmittel → Produkt + e- Oxidationszahl wird größer Inhaltsverzeichnis
Oxidation
- → Hauptartikel: Oxidation
Der Begriff Oxidation wurde in der Geschichte der Chemie unterschiedlich definiert:
- Antoine Laurent de Lavoisier verstand unter „Oxidation“ die Vereinigung von Elementen und chemischen Verbindungen mit dem Element Sauerstoff (Oxygenium), also die Bildung von Oxiden.
- Später erfolgte eine Erweiterung des Begriffes, indem man die Reaktionen mit einbezog, bei denen einer Verbindung Wasserstoff-Atome entzogen wurden (Dehydrierung).
- Auf Grundlage der Ionentheorie und des Bohrschen Atommodells konnte die Oxidation schließlich als Elektronenabgabe eines chemischen Stoffes aufgefasst werden:
-
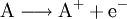
- Oxidation: Stoff A gibt ein oder mehrere Elektronen ab.
Die Oxidation ist nicht zwangsläufig mit einer vollständigen Abgabe von Elektronen und damit der Ionisation der beteiligten Stoffe verbunden – insbesondere in der Organischen Chemie und Biochemie.
Vor allem hier, in der Biologie und Biochemie, definiert man Oxidation nicht als „Abgabe von Wasserstoff“. Bei vielen biochemischen Vorgängen in der Zelle, z. B. der Glycolyse, werden organischen Verbindungen Wasserstoffatome durch bestimmte Coenzyme (NAD, NADP, FAD) „entrissen“.
Oxidationsmittel
- → Hauptartikel: Oxidationsmittel
Ein Oxidationsmittel ist ein Stoff, der den Reaktionspartner oxidiert: Er entreißt ihm Elektronen. Als Oxidation im ursprünglichen Sinn bezeichnete man zunächst nicht die Elektronenabgabe, sondern die chemische Reaktion eines Stoffes mit Sauerstoff. Auch heute noch assoziiert man mit diesem Begriff vielfach nur die Umsetzung mit Sauerstoff oder die Bildung von Oxiden: Sauerstoff ist hier das Oxidationsmittel.
Der Begriff der Oxidation wurde später auf Reaktionen erweitert, die nach dem gleichen chemischen Prinzip ablaufen, auch wenn kein Sauerstoff daran beteiligt ist. Neben Sauerstoff können auch andere nichtmetallische Elemente sowie viele chemische Verbindungen als Oxidationsmittel reagieren und Elektronen aufnehmen. Weitere, starke Oxidationsmittel neben Sauerstoff sind daher auch:
- die Halogene (Fluor, Chlor, Brom, Iod) sowie
- sauerstoffreiche Verbindungen mit Atomen in höchstmöglicher Oxidationszahl (wie Dichromat konzentrierte Schwefel- und Salpetersäure, Kaliumpermanganat, Kaliumperchlorat, Kaliumnitrat usw.) sowie
- Edelmetall-Kationen, denn auch sie haben ein hohes Bestreben, Elektronen an sich zu reißen.
Oxidationszahl
- → Hauptartikel Oxidationszahl
Die Oxidationszahl gibt an, wie viele Elektronen ein neutrales Atom innerhalb einer Verbindung formal aufgenommen (negative Werte) beziehungsweise abgegeben (positive Werte) hat. Die Oxidationszahl eines Atoms in einer Verbindung ist nur formal, also ein Maß der Elektronendichte um dieses Atom. Je höher die Oxidationszahl eines Atoms ist, desto niedriger ist die ihm zugeordnete Elektronendichte; negative Werte zeigen an, dass die Elektronendichte um das Atom erhöht ist. Bei einem Molekül werden Elektronenpaare dem Atom zugesprochen, dessen Elektronegativität höher ist. Zahlen gleichartiger Atomverbindungen werden untereinander gleich aufgeteilt. Ionen haben als Summe ihrer Oxidationszahlen ihre Ladungszahl, Moleküle die Summe 0. Bedeutend sind die Oxidationszahlen jener Atome, die Bestandteil einer funktionellen Gruppe sind.
Oxidationszahlen dienen bei Redoxreaktionen dazu, chemische Vorgänge besser zu erkennen. Bei der Übertragung von Elektronen von einem Atom auf ein anderes erhöht sich die Oxidationsstufe des abgebenden Atoms, die des anderen (das Elektronen aufnimmt) wird erniedrigt. Oft wird erst durch die Bestimmung der Oxidationszahlen einzelner Atome klar, ob hier eine Oxidation (Elektronenabgabe) oder eine Reduktion (Elektronenaufnahme durch das Oxidationsmittel) abläuft. Früher wurden die Oxidationszahlen in Verbindungen in römischen Ziffern über die Atomsymbole geschrieben (Bsp. O-II). Heute werden nach den Nomenklaturregeln der IUPAC die Oxidationsstufen in arabischen Ziffern mit voran gestellter Ionenladung über die Atomsymbole notiert.
Reduktion
- → Hauptartikel Reduktion
Das Wort Reduktion ist aus dem latein. reductio (= Zurückführung) abgeleitet und bedeutet in der gehobenen Alltagssprache eine Verringerung des Ausmaßes einer Eigenschaft. Dies kann sich sowohl auf messbare Größen (zum Beispiel Anzahl, Umfang, Gewicht) als auch auf abstrakte Größen beziehen. In der Chemie ist Reduktion eine chemische Reaktionsart, bei der Elektronen aufgenommen und Oxidationszahlen somit verringert werden.
Der Begriff Reduktion wurde in der Geschichte der Chemie ebenfalls unterschiedlich definiert:
- Antoine Laurent de Lavoisier verstand unter „Reduktion“ die Zerlegung von Oxiden in ein Element und Sauerstoff: Reduktion als Abgabe von Sauerstoff. Wenn z. B. rotes Quecksilberoxid gespalten wird, so handelt es sich um eine Reduktion: 2 HgO → 2 Hg + O2 Auch wenn man also Kupferoxid im Wasserstoffstrom erhitzt, so wird das Kupferoxid reduziert: Es entsteht metallisches Kupfer, da der Wasserstoff mit dem Sauerstoff des CuO Wasser bildet; dem CuO wird der Sauerstoff entzogen; und wenn man CuO zusammen mit Kohlenstoff in einem Reagenzglas über einem Gasbrenner erhitzt, erhält man Cu + CO2. Das CuO hat sich in Cu umgewandelt und der Sauerstoff ist nun im CO2. Das beim Versuch austretende CO2 lässt sich mit Kalkwasser nachweisen.
- Reduktion als Aufnahme von Wasserstoff: Auf einer höheren Ebene definiert man Reduktion als Aufnahme von Wasserstoff (und Oxidation als Abgabe von Wasserstoff). Wenn z. B. Acetaldehyd Wasserstoff aufnimmt, so entsteht Ethanol: CH3CHO + H2 → CH3CH2OH (Dieser Reduktionsbegriff ist vor allem für biologische Vorgänge wichtig. In vielen Stoffwechselwegen einer Zelle findet eine Reduktion durch Übertragung von Wasserstoff statt. Die Zelle hat dafür sogar besondere Coenzyme entwickelt, z. B. NAD, NADP oder FAD, welche in der Lage sind, Wasserstoff von einer Verbindung auf eine andere zu übertragen).
- Reduktion als Elektronenaufnahme: Reduktion bedeutet also Senken der Oxidationszahl und damit Aufnahme von Elektronen; Oxidation bedeutet die Abgabe von Elektronen und somit ein Erhöhen der Oxidationszahl. Wenn z. B. ein Eisennagel in eine Kupfersulfatlösung gestellt wird, bildet sich ein rotbrauner Belag von metallischem Kupfer auf dem Nagel, weil die Eisenatome Elektronen an die Kupferionen abgeben („Zementation“): Cu2+ + Fe → Cu↓+ Fe2+ Das Kupfer wird dabei reduziert, das Eisen oxidiert. In dieser allgemeinen Definition tritt die Reduktion immer zusammen mit der Oxidation auf.
Reduktionsmittel
- → Hauptartikel Reduktionsmittel
Das Reduktionsmittel ist dementsprechend der Stoff, der dem Reaktionspartner Elektronen zur Verfügung stellt: Er erniedrigt dessen Oxidationszahl. Es handelt sich also um einen Stoff, der andere Stoffe reduzieren kann und dabei selbst oxidiert wird (Elektronendonator) – also das Gegenteil zum Oxidationsmittel (Elektronenakzeptor).
Gute Reduktionsmittel (Elektronendonatoren) sind:
- Wasserstoff (H2)
- unedle Metalle (Alkali-, Erdalkalimetalle, Aluminium, Zink u.ähnl.)
- Kohlenstoff,
- kurzkettige Kohlenwasserstoffe
- Hydride wie Lithiumaluminiumhydrid und Natriumborhydrid,
- Schwefelwasserstoff und Natriumsulfid, Natriumsulfit, Natriumdithionit, Natriumthiosulfat,
Redoxreaktion
Nachweisreaktion für Sulfit: rosa Permanganatlösung (links) wird durch Sulfit entfärbt, das entstehende Sulfat dann mit Barium als Bariumsulfat gefällt (mitte), rechts verlief die Reaktion nicht vollständigDie Redoxreaktion ist eine Elektronen-Übertragung durch Oxidation und Reduktion. Wenn bei einer Stoffumwandlung eine Elektronenübertragung stattfindet, heißt das, dass eine Elektronenabgabe (Oxidation) und eine Elektronenaufnahme (Reduktion) ablaufen: Der Stoff, der Elektronen abgibt, ist das Reduktionsmittel (Elektronendonator, seine Oxidationszahl steigt) – das Oxidationsmittel nimmt sie auf (Elektronenakzeptor, seine Oxidationszahl wird kleiner).
Dieser Elektronenaustausch – zum Beispiel zwischen Ammonium- und Nitrationen im Düngemittel Ammoniumnitrat – kann bei falscher Handhabung unkontrolliert und explosionsartig verlaufen und hat in der Vergangenheit für zahlreiche Katastrophen im Zusammenhang mit Ammoniumnitrat gesorgt:
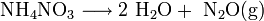
- Ammoniumnitrat reagiert zu Wasser und Distickstoffmonoxid (Lachgas)
Atome mit hoher Oxidationszahl sind ebenso wie die Halogene besonders gute Oxidationsmittel. Ein solches Beispiel ist Kaliumpermanganat, denn Mangan (Mn) hat hier die Oxidationszahl +VII. „Mühelos“ oxidiert es daher Sulfit- zu Sulfationen, Eisen(II)-Ionen zu Eisen(III)-Ionen und Salzsäure zu Chlorgas.
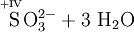

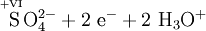
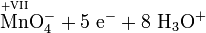

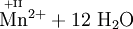
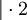
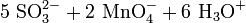

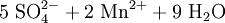
- Schema der Redoxreaktion von Sulfit mit Permanganat
Beispiele für verschiedene Arten von Elektronenaustausch
Sauerstoff als Oxidationsmittel
Ein klassisches Beispiel für die Oxidation durch das Oxidationsmittel Sauerstoff ist jede Art der Verbrennung von kohlenstoffhaltigen Stoffen unter Luftsauerstoff, z. B. Verbrennung von Kohle, Waldbrände, Benzin im Motor, Kerzen usw. Ausgehend von Kohle (reiner Kohlenstoff) gibt jedes Kohlenstoffatom vier Elektronen an zwei Sauerstoffatome zur Ausbildung von zwei Doppelbindungen ab. Es entsteht Kohlenstoffdioxid (CO2).
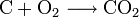
- Kohlenstoff und Sauerstoff reagieren zu Kohlenstoffdioxid
Ein von reinem Sauerstoff durchströmtes Kupferrohr kann so zum Beispiel mit einem Schweißbrenner entzündet werden. Die so gestartete Redoxreaktion liefert eine solch intensive Verbrennungswärme, dass sich mit dieser Sauerstofflanze mühelos ein dicker Stein- oder Felsbrocken aufschmelzen und durchdringen lässt. Reagiert also ein Metallatom mit einem Sauerstoff-Atom, so kann man die Oxidation des Metalles (hier: Kupfer) und somit die Metalloxidbildung anhand folgender Reaktionsgleichungen nachvollziehen:
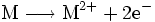
- Oxidation: Das Metall M gibt zwei Elektronen ab.
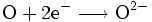
- Reduktion: Sauerstoff (O) nimmt zwei Elektronen auf.
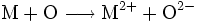
- Redoxreaktion: Sauerstoff oxidiert das Metall und wird dabei selbst reduziert.
Sauerstoff hat in diesem Fall das Bestreben, durch Aufnahme von zwei Elektronen eine stabile Valenzelektronenschale mit insgesamt acht Elektronen aufzubauen (Oktettregel). Das Metall wiederum kann durch Abgabe der Elektronen teilbesetzte Schalen auflösen und so die nächst niedrigere stabile Elektronenkonfiguration erreichen.
Sauerstoff reagiert als Oxidationsmittel also immer unter Aufnahme von 2 Elektronen pro Atom:
- Eisen rostet (korrodiert) unter dem Einfluss von Sauerstoff sowie Feuchtigkeit und bildet verschiedene Eisenoxide (Rost: Fe2O3, Fe3O4, FeO).
- Bei der Reaktion von Wasserstoff mit Sauerstoff (Knallgas) entsteht Wasser (H2O) und wird auch Knallgasreaktion genannt:
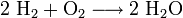
- Wasserstoff und Sauerstoff reagieren zu Wasser
Ein 2:1-Wasserstoff-Sauerstoff-Gasgemisch reagiert bei Zündung explosiv und wird daher Knallgas genannt. Dass die Redoxreaktion auch durch einen Platindraht als Katalysator in Gang gesetzt werden kann, entdeckte Johann W. Döbereiner. (Bereits 1816 gelang ihm mit Hilfe von Platinmoor die Oxidation von Alkohol zu Essigsäure.) Einige Jahre später gelang ihm die Entzündung eines Knallgasgemisches unter dem Einfluss von Platinschwamm. Diese Entdeckung führte zur Erfindung des ersten Feuerzeuges (des Döbereinerschen Platinfeuerzeugs).
Auch Nahrung wird im Körper in den vielen Schritten des biochemischen Stoffwechsels mit Hilfe von Sauerstoff aus der Atemluft u. a. zu körpereigenen Stoffen, Kohlenstoffdioxid (CO2) und Wasser oxidiert. Nicht nur in vivo, auch in vitro können organische Stoffe auf vielfältige Weise mit Sauerstoff reagieren: Ein primärer Alkohol (Alkanol) wird sanft oxidiert. Dabei entsteht zunächst ein Aldehyd (Alkanal), bei nochmaliger Oxidation eine Carbonsäure (Alkansäure).
Salzbildung
- → Hauptartikel: Salzbildungsreaktion
Die Reaktion von einem Metall und einem Nichtmetall wird als Salzbildung bezeichnet.
Halogene sind wie Sauerstoff so kräftige Oxidationsmittel, dass sie Metalle angreifen können (Korrosion). Zum Beispiel gibt bei der Entzündung des Alkalimetalles Natrium in Chlor das Natriumatom ein Elektron an das Chloratom ab, Natrium wird also durch Chlor zu Natriumchlorid oxidiert.
Im Gegenzug wird das Oxidationsmittel Chlor dabei reduziert:
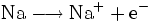
- Teilreaktion Oxidation: Natrium gibt ein Elektron ab.
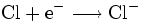
- Teilreaktion Reduktion: Im Gegenzug wird Chlor durch Aufnahme eines Elektrons reduziert.
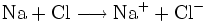
- Gesamtreaktion: Natrium und Chlor reagieren in einer Redoxreaktion miteinander.
Da Chlor nur molekular als Cl2 in die Reaktion eingeht, schreibt man genauer:
Zementation
- → Hauptartikel: Zementation
Die Reaktion von Edelmetallkation und Metall wird als Zementation bezeichnet. Beispielsweise erfolgt die Stoffumwandlung von Aluminium und Kupfersulfat zu Kupfer und Aluminiumsulfat als Redoxreaktion, da Aluminium als Reduktionsmittel Elektronen an die Kupfer(II)-Kationen des blauen Salzes abgibt:
Auf einem Zinkstab (als Reduktionsmittel), der in eine Lösung mit Kupfer-II-Ionen (Oxidationsmittel) taucht, scheidet sich ebenfalls elementares Kupfer ab (Zementation). Die Lösung wird mit Zink-II-Ionen angereichert.
Redoxreaktionen lassen sich in die Teilreaktionen Oxidation (Zn → Zn2+ + 2 e-) und Reduktion (Cu2+ + 2 e- → Cu) zerlegen.
Auch die Amalgamprobe – eine Nachweisreaktion für Quecksilbersalze mit Kupferblech – ist eine Redoxreaktion. Diese „Zementation“ verläuft nach dem Schema:
Der Elektronendonator – hier das Metall Kupfer als Nachweismittel – ist das Reduktionsmittel: Es hat die Aufgabe, andere Stoffe zu reduzieren, wird jedoch selber oxidiert. Der Elektronenakzeptor – hier das in Lösung befindliche Quecksilbersalz – ist das Oxidationsmittel, da er andere Stoffe oxidiert und selber Elektronen aufnimmt (reduziert wird). Auch an diesem Beispiel zeigt sich: Bei jeder Oxidation werden Elektronen abgegeben, sodass die Oxidationszahl ansteigt. Umgekehrt wird bei der Reduktion die Oxidationszahl verkleinert (reduziert).
Reaktion von Nichtmetall mit Nichtmetallanion
Elementares Chlor setzt – bei einer Halogenid-Nachweisreaktion in Wasser gelöst – aus Natriumiodid elementares Iod frei und es bildet sich Natriumchlorid (Kochsalz):
Die Oxidationszahl des Oxidationsmittels Chlor wird hier kleiner (von 0 nach −1): Es wird reduziert. Iodid hingegen wird zu Iod oxidiert, welches sich dann rotviolett in Hexan löst (Abbildung). Ähnlich reagiert Chlorwasser auch mit Bromid (was dann ein durch Brom rotorange gefärbtes Hexan ergibt).
Komproportionierung
Bei einer Komproportionierung (oder auch: Synproportionierung) reagieren Verbindungen, die ein Element in niedriger Oxidationstufe (Oxidationsmittel) enthalten, zusammen mit Verbindungen, in denen das betreffende Element in höherer Oxidationsstufe (Reduktionsmittel) vorliegt, zu einer Verbindung mit mittlerer Oxidationsstufe.
Beispiel: Blei und Blei-IV-oxid reagieren in der Batteriesäure eines Bleiakkumulators beim Entladen zu Blei-II-sulfat (Autobatterie):
Disproportionierung
Man spricht von einer Disproportionierung, wenn bei einer chemischen Reaktion Elemente mit mittlerer Oxidationsstufe in solche mit einer niedrigen und einer höheren übergehen. Diese Reaktionen verlaufen häufig unter dem Einfluss eines Katalysators (Stoff, der eine chemische Reaktion beschleunigt, ohne sich dabei zu verändern) ab.
Beispiel: Beim Erhitzen von Kaliumchlorat (Chlor mit Oxidationszahl +V) entsteht Sauerstoff, Kaliumchlorid (Chlor mit –I) und Kaliumperchlorat (Chlor mit +VII):
Großtechnische Redoxvorgänge
Zahlreiche Reaktionen aus dem Themenbereich der Metallurgie sind klassische Beispiele für technisch bedeutsame Redoxreaktionen in der Industrie. Beim Hochofenprozess wird Eisen mit Koks reduziert. Als Nebenreaktion unter anderem das starke Reduktionsmittel Kohlenmonoxid.
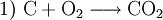
- Energie liefernde Verbrennung des Kokses.
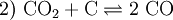
- Erzeugung des gasförmigen Reduktionsmittels Kohlenstoffmonoxid. Boudouard-Gleichgewicht
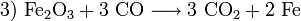
- Reduktion des Eisenoxids zu elementarem Eisen.
Zur Darstellung von zahlreichen Metallen aus ihren Oxiden kann Aluminiumpulver verwendet werden, wenn die Metalle unedler als Aluminium. Das Verfahren wird Aluminothermie genannt. Die Mischung von Eisenoxid und Aluminium wird Thermit genannt und beispielsweise zum Zusammenschweißen von Eisenbahnschienen und für Brandbomben verwendet.Redoxvorgänge in der Biochemie
Viele zellbiologische Prozesse beinhalten Redox-Reaktionen. Bei der Zellatmung wird Traubenzucker (Glucose) zu Kohlenstoffdioxid oxidiert und Sauerstoff zu Wasser reduziert. Die Summenformel lautet:
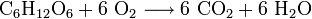
- Aus einem Molekül Glucose und sechs Molekülen Sauerstoff werden sechs Moleküle Kohlenstoffdioxid und sechs Moleküle Wasser.
Die Umkehrreaktion ist die Photosynthese bei der grüne Pflanzen aus Kohlenstoffdioxid und Wasser – durch Energiezufuhr (Licht; Chlorophyll) – Traubenzucker (Glucose) aufbauen und Sauerstoff freisetzen. Die Brutto-Reaktionsgleichung lautet:
Der Blutfarbstoff Hämoglobin ist ein Eisenkomplex im Blut, dessen Struktur sich mit der Aufnahme (Oxigenierung) bzw. der Abgabe von Sauerstoff (Desoxigenierung) ändert. Es handelt sich um eine Komplexbildungsreaktion, keine Redoxreaktion. Sollte Hämoglobin doch einmal oxidiert werden, so erhält man Hämiglobin, eine Hämoglobin-Form, die nicht in der Lage ist, Sauerstoff zu transportieren.Redoxvorgänge und Elektrochemie
Eine freiwillig ablaufende Redoxreaktion geschieht fast immer unter Abgabe von Licht- und /oder Wärmeenergie (exotherm). Wenn Oxidation und Reduktion zusätzlich räumlich getrennt voneinander ablaufen, so wird ein solches System Galvanisches Element genannt – der Elektronenfluss kann hier zur Energiegewinnung genutzt werden (Beispiel: Batterie, Akkumulator). Von außen erzwungene Redoxreaktionen benötigen einen entsprechenden Energieaufwand (Beispiel: Elektrolyse).
Die Elektrochemie ist das Teilgebiet der Physikalischen Chemie, welches sich mit dem Zusammenhang zwischen elektrischen und chemischen Vorgängen befasst. Wenn daher eine Redoxreaktion durch einen elektrischen Strom erzwungen wird oder einen solchen liefert, so ist dies ein elektrochemischer Vorgang.
Galvanische Elemente, Akkumulatoren und Elektrolyse
Wird die Redoxreaktion durch eine von außen angelegte elektrische Spannung erzwungen, so nennt man diesen Vorgang Elektrolyse – wird durch die chemische Reaktion geeigneter Substanzen eine messbare Spannung hervorgerufen, so liegt ein galvanisches Element vor. Diese Spannungen (Redoxpotentiale) sind charakteristisch für die jeweiligen Reaktionen und sind auf einer Skala dokumentiert, der elektrochemischen Spannungsreihe. Hier wird also die Stärke eines Oxidations- oder Reduktionsmittels messbar.
Elektrochemische Redoxreaktionen laufen in einer galvanischen Zelle ab:
- Bei der Elektrolyse und dem Aufladen eines Akkumulators wird dabei elektrische Energie zugeführt,
- beim Entladen einer Batterie oder bei Stromentnahme aus einer Brennstoffzelle erhält man elektrische Energie, die im reversiblen Fall bei einem gegen Null tendierendem elektrischen Strom (I = 0) der Gibbs-Energie der Reaktion entspricht.
Die für die Elektrochemie entscheidenden Vorgänge laufen dabei an der Phasengrenze Elektrode-Elektrolyt ab – Elektrochemie ist also die Wissenschaft der Vorgänge an der Phasengrenze zwischen einem Elektronenleiter (Elektrode) und einem Ionenleiter (Elektrolyt).
Anwendungen der Elektrochemie
- Herstellung chemischer Substanzen
- Reduktion von Metallsalzen zur Herstellung unedler Metalle, vor allem durch Schmelzelektrolyse, z. B. zur Herstellung von Lithium, Natrium, Kalium, Calcium, Magnesium und Aluminium
Der elektrische Strom wirkt hier als Reduktionsmittel. Da die Spannung variiert werden kann, kann die Reduktionskraft angepasst werden. Der elektrische Strom ist das stärkste Reduktionsmittel der Chemie, mit dem auch die unedelsten Metalle reduziert werden können.
Die elektrolytische Metallabscheidung wird auch in der Galvanotechnik genutzt. - Oxidation von Anionen, z. B. von Halogeniden, etwa zur Herstellung von Fluor und Chlor
- Der elektrische Strom erlaubt Redoxreaktionen ohne die Zugabe von Reduktions- oder Oxidationsmitteln. Viele weitere Redoxreaktionen können daher elektrolytisch besonders elegant ausgeführt werden oder werden erst ermöglicht. Erwähnt seien die Elektrofluorierung oder die Kolbe-Elektrolyse.
- Reduktion von Metallsalzen zur Herstellung unedler Metalle, vor allem durch Schmelzelektrolyse, z. B. zur Herstellung von Lithium, Natrium, Kalium, Calcium, Magnesium und Aluminium
- Galvanotechnik
- Bereitstellung einer elektrischen Spannung, vor allem für mobile Anwendungen, in:
- Galvanische Zellen (Monozellen)
- Batterie
- Akkumulatoren
- Brennstoffzellen
- Verwendung des elektrischen Stroms zur Durchführung von chemischen Analysen und Untersuchungen: Elektroanalyse, vor allem Polarographie
- Untersuchungen zur Thermodynamik und zum Mechanismus von Reaktionen, wichtig auch für die Korrosionsforschung
Literatur
- Michael Wächter: Stoffe, Teilchen, Reaktionen. Verlag Handwerk und Technik, Hamburg 2000, S. 154–169 ISBN 3-582-01235-2
- Bertram Schmidkonz: Praktikum Anorganische Analyse. Verlag Harri Deutsch, Frankfurt 2002, ISBN 3-8171-1671-3
- Peter W. Atkins, Physikalische Chemie, Wiley-VCH, ISBN 3-527-30236-0
- C.H. Hamann, W. Vielstich, Elektrochemie, Wiley-VCH, 3. Aufl. 1998 ISBN 978-3527278947
- W.Schmickler, Grundlagen der Elektrochemie, Springer 1996 ISBN 978-3540670452
- L.Landen und Dr. Kledt, Grundwissen Chemie 1, Klett 2005
- Schüring, J., Schulz, H. D., Fischer, W. R., Böttcher, J., Duijnisveld, W. H. (editors)(1999). Redox: Fundamentals, Processes and Applications, Springer-Verlag, Heidelberg, 246 pp. ISBN 978-3540665281 (pdf 3,6 MB)
Weblinks
Wikimedia Foundation.









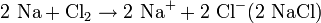
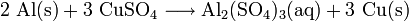
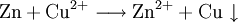

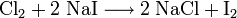
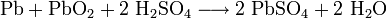
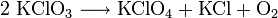 (
(