- Stereoelektronische Effekte
-
Stereoelektronische Effekte sind räumliche Orientierungen von Molekülen oder bestimmte Verläufe einer chemischen Reaktion, welche sich aus der räumlichen Anordnung von Molekülorbitalen ergeben. Die Bevorzugung dieser folgt dabei aus Donor-Akzeptor-Wechselwirkungen dieser Orbitale.
Inhaltsverzeichnis
Grundlagen
Die Grundlagen stereoelektronischer Effekte folgen aus der Molekülorbitaltheorie. Wechselwirken zwei Orbitale so spalten sich diese auf in ein Orbital mit einer niedrigeren energetischen Lage als die Ausgangsorbitale, und eines mit einer höheren energetischen Lage als die Ausgangsorbitale. Es können dabei nicht nur zwei Atomorbitale, sondern auch zwei Molekülorbitale wechselwirken und so einen Energiegewinn erreichen.
Eine solche Wechselwirkung ist je stärker, je näher die wechselwirkenden Orbitale von ihrer Energie sind, und je besser die räumliche Anordnung eine solche Überlappung ermöglicht. Berechenbar ist die Größe der Überlappung dabei durch das Überlappungsintegral der beiden Orbitale.
Im Unterschied zu Atomorbitalen wechselwirken bei Molekülorbitalen jedoch nicht zwei einfach besetzte Orbitale sondern ein gefülltes σ- oder n-Orbital wechselwirkt mit einem nicht gefüllten σ* Orbital. Die Tendenz die beiden Elektronen zum Teil in diese neue Wechselwirkung einzubringen ist dabei stärker, je weniger elektronegativ der Substituent der Elektronen beisteuernden Bindung (Elektronen-Donor-Bindung) ist. Dadurch ergibt sich die folgende Reihe für die Donorstärke von Bindungen: H3C-CH3 > H3C-H > H3C-NH2 > H3C-OH > H3C-F[1]. Dies ergibt sich daraus, dass die Lage des Donor-Orbitals je niedriger (und damit für die Wechselwirkung schlechter) ist, je größer die Elektronegativität der beteiligen Atome ist.
Für die Tendenz von nichtbindenden Orbitalen die Elektronen abzugeben sieht es dabei genauso aus. Je elektronegativer das Atom an dem sich das Orbital befindet, desto niedriger die Energie des Orbitals, desto schlechter die Donoreigenschaft. Daraus ergibt sich die folgende Reihe: H3P > H2S >H3N >H2O > HF.
Mit der Akzeptoreigenschaft von σ* Orbitalen verhält es sich im Grunde genau andersherum. Je höher die Elektronegativität der beteiligten Atome desto höher ist auch die Akzeptoreigenschaft des σ* Orbitals. Auch hier ergibt sich damit eine Reihung: H3C-H < H3C-CH3 < H3C-NH2 < H3C-OH < H3C-F.
Der Gauche-Effekt
Liegen zwei Substituenten mit großem sterischen Anspruch (also einer großen räumlichen Ausdehnung) an benachbarten C-Atomen vor, so ordnen sie sich bevorzugt antiperiplanar an. Um dies deutlich darzustellen wird die Newman-Projektion verwendet. Bei bestimmten Verbindungen ist dagegen eine synclinale (alt auch gauche) Anordnung der Substituenten bevorzugt. Dies tritt vor allen Dingen dann auf, wenn Substituenten mit hoher Elektronegativität und damit einer starken σ*-Akzeptorbindung beteiligt sind.
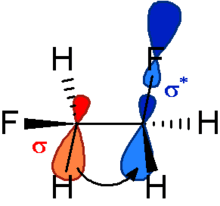
So liegt 1,2-Difluorethan immer in der synclinalen oder alt in der gauche-Anordnung vor. Die größte Überlappung zwischen einem σ und einem σ*-Orbital liegt bei einer antiperiplanaren Anordnung der Bindungen vor (siehe Abb. 1). Da die C-F Bindung sowohl ein sehr schlechter Donor als auch ein sehr guter Akzeptor ist, ist die antiperiplanare Anordnung zu besseren C-H-Donorbindung wesentlich günstiger und die beiden Fluor-Atome ordnen sich synclinal an.
Der Anomere Effekt
Hauptartikel: Anomerer Effekt
Der anomere Effekt tritt bei gesättigten Sechsgliedrigen Ringen auf , welche ein Heteroatom (also ein anderes Atom als Kohlenstoff) im Ring enthalten, welches ein nichtbindendes Orbital trägt. Des Weiteren gibt es am Benachbarten Kohlenstoffatom eine Bindung mit starken σ*-Akzeptoreigenschaften. Die beste Überlappung ergibt sich dabei, wenn das nichtbindende Orbital antiperiplanar zur Bindung des Atoms mit Akzeptoreigenschaft steht. Daraus ergibt sich bei einem Tetrahydropyran, dass sich der Substituent außerhalb der Ebene des Ringes (axial) anordnet.
Fußnoten
- ↑ Alabugin, Zeidan, J. Am. Chem. Soc., 2002, 124, 3175-3185
Literatur
- Kirby: Stereoelectronic Effects, Oxford University Press, Oxford 1996
- Clayden, Greeves, Warren, Wothers: Organic Chemistry, Oxford University Press , Oxford 2001
Wikimedia Foundation.