- Tetrahydropyran
-
Strukturformel 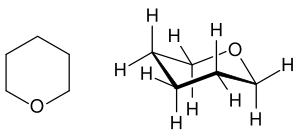
Allgemeines Name Tetrahydropyran Andere Namen - Pentamethylenoxid
- Oxan
- Oxacyclohexan (IUPAC-Name)
- THP
Summenformel C5H10O CAS-Nummer 142-68-7 PubChem 8894 Kurzbeschreibung farblose, hygroskopische, leichtentzündliche Flüssigkeit mit unangenehm süßlichem Geruch[1]
Eigenschaften Molare Masse 86,13 g·mol−1 Aggregatzustand flüssig
Dichte 0,88 g·cm−3[1]
Schmelzpunkt Siedepunkt 88 °C[1]
Löslichkeit mäßig in Wasser (80,2 g·l−1 bei 20 °C)[1]
Brechungsindex 1,421[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 

Gefahr
H- und P-Sätze H: 225-315-319-335 EUH: keine EUH-Sätze P: 210-261-305+351+338 [3] EU-Gefahrstoffkennzeichnung [1] 

Leicht-
entzündlichReizend (F) (Xi) R- und S-Sätze R: 11-36/37/38 S: 9-16-26-33-36 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C Tetrahydropyran ist eine heterocyclische, sauerstoffhaltige, chemische Verbindung aus der Gruppe der cyclischen Ether. Es ist eine farblose Flüssigkeit mit unangenehm süßlichem Geruch. Sie ist leichtentzündlich und bildet am Licht in Gegenwart von Luft explosive Peroxide. Deshalb wird sie meist mit Stabilisatorzusätzen versehen.
Inhaltsverzeichnis
Vorkommen
Der Tetrahydropyranring bildet recht häufig die Grundstruktur in Naturstoffen. So kommt er in Kohlenhydraten, wie zum Beispiel Rohrzucker, Traubenzucker und Galactose vor und wird dort als Pyranoseform bezeichnet. Der sehr kompliziert gebaute Naturstoff Maitotoxin, ein starker Giftstoff, der von marinen Algen produziert wird, enthält 28 Tetrahydropyranringe im Molekülgerüst.
Gewinnung und Darstellung
Eine Standardmethode zur Synthese von Tetrahydropyran ist die Hydrierung von Dihydropyran mit Raney-Nickel als Katalysator.
Eigenschaften
Seine Dämpfe sind 2,98 mal schwerer als Luft. Der Tetrahydropyranring bildet im Raum keine planare Struktur, sondern meist eine Sesselform aus[4].
Verwendung
Tetrahydropyran wird gelegentlich als Lösungsmittel bei Grignard-Reaktionen verwendet. Es bildet weiterhin die Basis für viele abgeleitete Verbindungen (z.B. Tetrahydropyran-2,6-dion und Tetrahydropyran-2,4-diole).
Als Schutzgruppe
Bei organischen Synthesen wird die 2-Tetrahydropyranylgruppe als Schutzgruppe für Alkohole und Thiole benutzt. Dazu wird das Substrat mit Dihydropyran zum basenstabilen Tetrahydropyranylether umgesetzt.
Sicherheitshinweise
Bei Kontakt von Tetrahydropyran mit Luft bilden sich Peroxide und explosive Dämpfe.
Siehe auch
- Tetrahydrofuran (THF)
- Pyrane
Literatur
- Strategies for the Formation of Tetrahydropyran Rings in the Synthesis of Natural Products bei DOI
- Kombinatorische Synthese einer Tetrahydropyran-Bibliothek per Prins-Cyclisierung
Weblinks
Einzelnachweise
- ↑ a b c d e f Eintrag zu CAS-Nr. 142-68-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. September 2007 (JavaScript erforderlich).
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b Datenblatt Tetrahydropyran bei Sigma-Aldrich, abgerufen am 24. April 2011.
- ↑ Hinweis aus: „Organisch-chemische Blockvorlesung der Universität Stuttgart“
Kategorien:- Feuergefährlicher Stoff
- Reizender Stoff
- Oxan
Wikimedia Foundation.
