- Wanzlick-Gleichgewicht
-
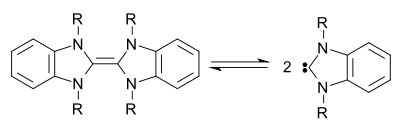
Unter einem Wanzlick-Gleichgewicht versteht man eine chemische Gleichgewichtsreaktion zwischen einem stabilen Carben und seinem Dimeren.
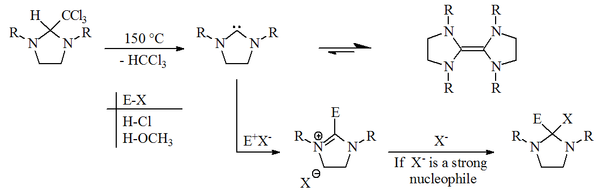
In den 1960er Jahren vermuteten Hans-Werner Wanzlick und E. Schikora, dass die Herstellung eines Carbens mit der Dihydroimidazol-2-yliden-Struktur durch eine Vakuumpyrolyse eines 2-Trichlormethyldihydroimidazol-Derivates unter Abspaltung von Chloroform möglich sein sollte.[1][2]
Beide glaubten, dass ein so hergestelltes Carben zu einem geringen Teil in einem Gleichgewicht mit seinem Dimeren steht. Dies schlossen sie aus Reaktivitätsstudien, da bei der Umsetzung mit einem Elektrophil das Produkt der elektrophilen Substitution erhalten wurde. Das Dimer wäre zu dieser Reaktion nicht in der Lage.[3]
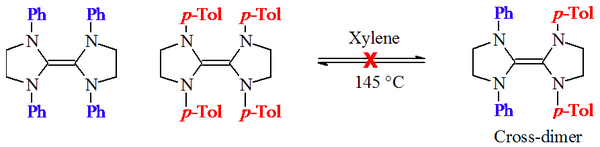
Die Hypothese des Carben-Dimer-Gleichgewichtes wurde von D. M. Lemal[4] und H. E. Winberg[5] untersucht. Dabei erhitzten sie eine Mischung von zwei verschieden substituierten Tetraaminoethylenen.
Bei diesen Experimenten konnten keine gekreuzten Dimere gefunden werden, was jedoch nach der Hypothese von Wanzlick der Fall hätte sein müssen. Sie deuten eher darauf hin, dass es im Falle der Dihydroimidazol-2-yliden-Derivate kein Carben-Dimer-Gleichgewicht gibt.
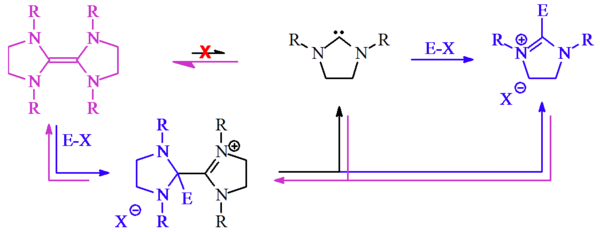
Lemal schlug einen alternativen Mechanismus für die Ergebnisse von Wanzlick vor, unter Berücksichtigung der Reaktivität der elektronenreichen Tetraaminoethylene und nicht der der stabilen Carbene,[4] welche zu diesem Zeitpunkt nur als Hypothese existierten.[2]
Lemal glaubte, dass ein Tetraaminomethylen und nicht das Carben mit dem Elektrophil E-X über eine kationische Zwischenstufe reagiert. Er schlug vor, dass das Kation zu einem Carben und einem Salz dissoziiert. Das freie Carben kann dann zur Ausgangsverbindung dimerisieren oder mit dem Elektrophil reagieren. Beide Wege führen zu denselben Reaktionsprodukten, dem Dihydroimidazolium-Salz.
Im Jahr 1999 untersuchte M. Denk erneut das Kreuz-Experiment und konnte das gekreuzte Dimer beobachten..[7] Diese Ergebnisse veranlassten Lemal, seine Experimente von 1964 zu wiederholen. Es gelang, die Resultate von Denk zu reproduzieren, jedoch nur in Deutero-THF als Lösungsmittel. In Toluol und einem Elektrophil-Fänger gelang es erneut nicht, das gekreuzte Produkt nachzuweisen.[8]
Im Jahr 1999 bzw. 2000 konnten Lemal[9] und Hahn[10] ein Gleichgewicht zwischen Dibenzotetrafulvalen-Derivaten und seinen Carbenen beobachten. Diese Beobachtung ließ Böhm und Herrmann 2000 zu dem Schluss kommen, dass ein Wanzlick-Gleichgewicht zwischen Tetraaminoethylen und dem entsprechenden Carben existiert,[11] was 2010 von Kirmse bestätigt wurde.[12]
In weiteren Untersuchungen von Alder konnte gezeigt werden, dass ungehinderte Diaminocarbene unter Säurekatalyse wie von Lemal beobachtet ein Dimeres bilden. Überschüsse an Säure bilden ein dimeres Salz.[13]
Einzelnachweise
- ↑ Hans-Werner Wanzlick, E. Schikora: „Ein neuer Zugang zur Carben-Chemie“ in Angewandte Chemie 1960, 72, 494 doi:10.1002/ange.19600721409.
- ↑ a b H. W. Wanzlick, E. Schikora: Ein nucleophiles Carben in Chemische Berichte 1960, 94, 2389–2393 doi:10.1002/cber.19610940905
- ↑ H. W. Wanzlick: „Aspects of Nucleophilic Carbene Chemistry“ in Angew. Chem., Int. Ed. Engl. 1962, 1, 75 doi:10.1002/anie.196200751.
- ↑ a b D. M. Lemal, R. A. Lovald, K. I. Kawano: „Tetraaminoethylenes. The Question of Dissociation“ in J. Am. Chem. Soc. 1964, 86, 2518 doi:10.1021/ja01066a044
- ↑ H. E. Winberg, J. E. Carnahan, D. D. Coffman, M. Brown: „Tetraaminoethylenes“ in J. Am. Chem. Soc. 1965, 87, 2055 doi:10.1021/ja01087a040
- ↑ T. A. Taton, P. Chen: Angew. Chem., Int. Ed. Engl. 1996, 35, 1011 doi:10.1002/anie.199610111
- ↑ Michael K. Denk, Ken Hatanoa, Martin Maa: Nucleophilic carbenes and the wanzlick equilibrium: A reinvestigation in Tetrahedron Letters 1999, 40, 2057-2060doi:doi:10.1016/S0040-4039(99)00164-1
- ↑ Yufa Liu, David M. Lemal: Concerning the Wanzlick equilibrium in Tetrahedron Letters 2000, 41, 599-602 doi:10.1016/S0040-4039(99)02161-9
- ↑ Yufa Liu, Patrick E. Lindner, David M. Lemal: Thermodynamics of a Diaminocarbene−Tetraaminoethylene Equilibrium. J. Am. Chem. Soc. 1999, 121, 10626–10627 doi:10.1021/ja9922678
- ↑ F. Ekkehardt Hahn, Lars Wittenbecher, Duc Le Van, Roland Fröhlich: Evidence for an Equilibrium between an N-heterocyclic Carbene and Its Dimer in Solution. Angewandte Chemie International Edition 2000, 39, 541-544 Abstract
- ↑ Volker P. W. Böhm, Wolfgang A. Herrmann: The Wanzlick Equilibrium Angew. Chem. 2000, 39, 4036-4038 doi:10.1002/1521-3773(20001117)39:22<4036::AID-ANIE4036>3.0.CO;2-L
- ↑ Kirmse, W.: The Beginnings of N-Heterocyclic Carbenes. Angewandte Chemie International Edition 2010, 49, 8798–8801. doi:10.1002/anie.201001658
- ↑ Roger W. Alder, Leila Chaker, François P. V. Paolini: Bis(diethylamino)carbene and the mechanism of dimerisation for simple diaminocarbenes Chem. Commun. 2004, 2172–2173 doi:10.1039/b409112d.
Kategorien:- Kinetik (Chemie)
- Kohlenstoffverbindung
Wikimedia Foundation.