- Delokalisierung
-
Ist eine Ladung in einer Atomgruppe (Molekül oder Molekülion) nicht genau lokalisierbar, sondern über die einzelnen Atome verteilt, so spricht man von Delokalisierung.[1] Oft wird auch von π-Elektronensystem gesprochen. Zur Beschreibung dieser Ladungsverteilung nach der VB-Theorie verwendet man mesomere Grenzstrukturen.
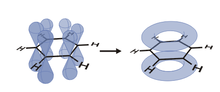
Ein Spezialfall dieser delokalisierten Ladungen findet sich in konjugierten Systemen aromatischer Verbindungen, deren π-Elektronen nicht in isolierten, zwei C-Atomen zugehörigen π-Orbitalen lokalisiert sind, sondern Molekülorbitalen angehören, die sich über mehrere C-Atome erstrecken. Die π-Elektronen sind dabei in einer „Elektronenwolke“ über die Kohlenstoffatome des gesamten aromatischen Systems verteilt.
Ein klassisches Beispiel für ein Molekül mit delokalisierten π-Elektronen ist das Benzol, dessen Grenzstrukturen erstmals 1872 von Kekulé korrekt postuliert wurden.
Moleküle oder Metallkomplexe mit großen delokalisierten Elektronensystemen sind häufig farbig, etwa organische Verbindungen wie Carotinoide oder Charge-Transfer-Komplexe wie das Kaliumpermanganat. Weitere Beispiele sind Sandwich-Komplexe wie Ferrocen und Titanocen.
Einzelnachweise
- ↑ Eintrag: delocalization. In: IUPAC Compendium of Chemical Terminology (the “Gold Book”). doi:10.1351/goldbook.D01583.
Wikimedia Foundation.