- Dimethylglyoxim
-
Strukturformel 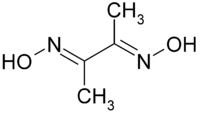
Allgemeines Name Dimethylglyoxim Andere Namen - Diacetyldioxim
- Diacetylglyoxim
- DMG
- 2,3-Butandiondioxim
- Tschugaeff-Reagenz
Summenformel C4H8N2O2 CAS-Nummer 95-45-4 PubChem 5323784 Kurzbeschreibung farbloses, geruchloses Pulver [1] Eigenschaften Molare Masse 116,12 g·mol−1 Aggregatzustand fest
Schmelzpunkt 245–246 °C (Zersetzung) [1]
Löslichkeit wenig löslich in Wasser (0,6 g·l−1 bei 20 °C)[2], löslich in Alkohol, Aceton, Ether, und Pyridin
Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 WGK 2 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Dimethylglyoxim, auch Diacetyldioxim (DADO), ist ein organisch-chemischer Komplexbildner.
Eigenschaften
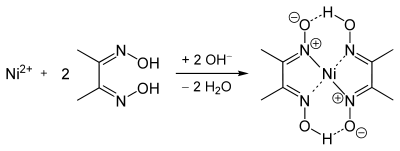
Dimethylglyoxim ist ein Komplexbildner, der mit Schwermetallsalzen, wie Ni-, Fe-, Bi-, Co-, Cu-, Pb-, Pt-, Pd- und Re-Salzen farbige Chelatkomplexe bildet.
Besonders das rosarote[4] bis himbeerrote[5], sehr schwer lösliche Bis(diacetylglyoximato)nickel(II) (Nickel-Dimethylglyoxim-Komplex; [Ni(dmg)2]) in ammoniakalischer Lösung dient als qualitativer Nickel(II)-Nachweis und wird zur quantitativen Bestimmung (Fotometrie) für Nickelsalze genutzt. Diese Chelatverbinung weist einen quadratisch, ebenen Bau auf.[5] Im Festzustand formen sich die Komplexe zu Molekülstapeln, dessen Ni–Ni-Abstände jeweils 325 pm betragen.[6]
Darüber hinaus dient die Bildung des Nickelkomplexes auch zur Abtrennung von Cobalt(II), da dieses einen analogen, doch im Gegensatz dazu wasserlöslichen Komplex mit Diacetyldioxim bildet.[6]
Der Komplex wurde erstmals 1905 von Lew Alexandrowitsch Tschugajew beschrieben.[7]
Die Färbung kann noch bis zu einer Verdünnung von 1:106 erkannt werden. Mit Zitronensäure in alkalischer Lösung können störende Ionen maskiert werden.
In ammoniakalischen Lösungen bilden sich folgende Färbungen/Niederschläge:
- Nickel: himbeerrot
- Kupfer: braunrot
- Eisen(II): rot
- Cobalt: braunrot
- Bismut: intensiv gelb
- Blei: weiß (voluminös, fein verteilt)
- Palladium: gelb-gelblich
Reagenz
- Gesättigte Lösung von Dimethylglyoxim in 96%igem Ethanol
- Wässrige Lösung mit 0,1 mol/l Dinatriumbis(dimethylglyoximat)
Quellen
- ↑ a b Hermann Römpp, Jürgen Falbe und Manfred Regitz: Römpp Lexikon Chemie. 9. Auflage, Georg Thieme Verlag, Stuttgart, 1992.
- ↑ a b Eintrag zu Dimethylglyoxim in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 1. Sep. 2007 (JavaScript erforderlich)
- ↑ Diacetyldioxim bei ChemIDplus
- ↑ Wittko Francke und Wolfgang Walter: Lehrbuch der Organischen Chemie. S. Hirzel Verlag Stuttgart; 24. überarb Auflage 2004, ISBN 3-7776-1221-9; S. 342
- ↑ a b Wolfgang Werner: Qualitative anorganische Analyse: für Pharmazeuten und Naturwissenschaftler Deutscher Apotheker Verlag; 4. völlig neu bearb. u. erw. Auflage 2006; ISBN 3-8047-2264-4; S. 95
- ↑ a b Nils Wiberg, Egon Wiberg und Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. Gruyter Verlag; 102., stark umgearb. u. verb. Auflage 2007; ISBN 978-3-11-017770-1; S. 1715
- ↑ Lev Tschugaeff (1905): Über ein neues, empfindliches Reagens auf Nickel. In: Berichte der deutschen chemischen Gesellschaft. Bd. 38, Nr. 3, S. 2520-2522. doi:10.1002/cber.19050380317
Wikimedia Foundation.