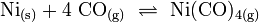- Nickelerz
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Nickel, Ni, 28 Serie Übergangsmetalle Gruppe, Periode, Block 10, 4, d Aussehen glänzend, metallisch, silbrig CAS-Nummer 7440-02-0 Massenanteil an der Erdhülle 0,01 % Atomar Atommasse 58,6934 u Atomradius (berechnet) 135 (149) pm Kovalenter Radius 121 pm Van-der-Waals-Radius 163 pm Elektronenkonfiguration [Ar]3d84s2 Elektronen pro Energieniveau 2, 8, 16, 2 Austrittsarbeit 5,01–5,2 eV 1. Ionisierungsenergie 737,1 kJ/mol 2. Ionisierungsenergie 1753 kJ/mol 3. Ionisierungsenergie 3395 kJ/mol 4. Ionisierungsenergie 5300 kJ/mol Physikalisch Aggregatzustand fest Kristallstruktur kubisch flächenzentriert Dichte 8,908 g/cm3 Mohshärte 3,8 Magnetismus ferromagnetisch Schmelzpunkt 1728 K (1455 °C) Siedepunkt 3186 K (2913 °C) Molares Volumen 6,59 · 10−6 m3/mol Verdampfungswärme 370,4 kJ/mol Schmelzwärme 17,47 kJ/mol Dampfdruck 237 Pa bei 1726 K Schallgeschwindigkeit 4970 m/s bei 293,15 K Spezifische Wärmekapazität 440 J/(kg · K) Elektrische Leitfähigkeit 14,3 · 106 A/(V · m) Wärmeleitfähigkeit 90,7 W/(m · K) Chemisch Oxidationszustände 2, seltener −1, 0, 1, 3, 4 Oxide (Basizität) NiO, Ni2O3 (leicht basisch) Normalpotential −0,257 V (Ni2+ + 2e− → Ni) Elektronegativität 1,91 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE MeV ZP 56Ni 6,077 d ε 2,136 56Co 57Ni 35,60 h ε 3,264 57Co 58Ni 68,077 %
Stabil 59Ni 76000 a ε 1,072 59Co 60Ni 26,233 %
Stabil 61Ni 1,14 %
Stabil 62Ni 3,634 %
Stabil 63Ni 100,1 a β− 2,137 63Cu 64Ni 0,926 %
Stabil 65Ni 2,5172 h β− 2,137 65Cu 66Ni 54,6 h β− 0,225 66Cu NMR-Eigenschaften Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [1] Pulver

Giftig (T) R- und S-Sätze R: 40-43-48/23-52/53 S: (2)-36/37/39-45-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Nickel ist ein chemisches Element mit dem Symbol Ni und der Ordnungszahl 28.
Inhaltsverzeichnis
Geschichte
Nickel wurde bereits 3400 v. Chr. benutzt, aber wohl nicht absichtlich und gezielt. Bronze aus dem Gebiet des heutigen Syriens enthielt bis zu zwei Prozent Nickel, das wohl schon im Kupfer- oder Zinnerz enthalten war. Chinesische Schriften bezeugen, dass in Asien „weißes Kupfer“ (Neusilber) zwischen 1700 und 1400 v. Chr. verwendet wurde. Es war lange bekannt, dass antike Münzen Kupfernickel enthalten.
1710 schrieb Christoph Hettwig bezüglich Bergleute er im Wetter lieget, frist ihn der Kupfer-Nickel dermassen... 1726 schrieb Joh. Henr. Linckio Linck quod apparet in illa Cobalti minera, quae Kupfer-Nickel appellatur et adhuc cruda cuprem colorem prae se fort.
Nickel wurde jedoch erstmals 1751 von Axel Frederic Cronstedt rein dargestellt. Er nannte das Metall 1754 Nickel, abgeleitet von Kupfernickel (schwedisch kopparnickel), dem aus dem Erzgebirge stammenden Wort für Rotnickelkies. So nannten Bergleute das Erz, das aussah wie Kupfererz, aus dem sich aber kein Kupfer gewinnen ließ, als sei es von Berggeistern („Nickeln“) verhext. Eine ähnliche Etymologie findet sich bei Cobalt.
Die erste Münze aus reinem Nickel wurde 1881 geprägt.
Vorkommen
Nickel kommt gediegen nur in Eisenmeteoriten und im Erdkern vor. Es ist relativ weit, meist aber in geringen Konzentrationen verbreitet. Sein Massenanteil an der Erdhülle beträgt etwa 0,01 %. Wichtige Nickelerze sind: Garnierit ((Mg,Ni)3(OH))4[Si2O5]), Gelbnickelkies (NiS) und Rotnickelkies (NiAs). Der größte Teil der Nickelproduktion wird aus nickelhaltigen Erzen gewonnen, vor allem Nickelmagnetkies, der Chalkopyrit CuFeS2, Pentlandit (Ni,Fe)9S8 und Spuren von Edelmetallen enthält. Um das Nickel wirtschaftlich abbauen zu können, muss der Nickelgehalt des Erzes mindestens 0,5 % betragen. Die wichtigsten Vorkommen finden sich in Kanada (Sudbury-Becken), Neukaledonien, Russland (Norilsk und Halbinsel Kola), Australien und Kuba. Ein häufiger Begleiter des Nickels ist Cobalt.
Fördermengen von Nickel[2] Land Tausend Tonnen pro Jahr Prozent der Weltproduktion Russland 300,7 23,4 Australien 218,0 17,0 Kanada 162,8 12,7 Neukaledonien 111,9 8,7 Indonesien 103,5 8 5 Länder total 896,9 69,8 Welt 1 284,2 100,0 Gewinnung und Darstellung
Darstellung des Kupfer-Nickel-Feinsteins
Der überwiegende Teil des Nickels wird aus nickel- und kupferhaltigen Eisenerzen wie Nickelmagnetkies gewonnen. Um die Gewinnung wirtschaftlich zu machen, muss das Nickel zunächst durch Flotation auf etwa fünf Prozent Nickelgehalt angereichert werden. Danach wird das Erz ähnlich wie bei der Kupferherstellung geröstet. Dabei wird das Erz zunächst vorgeröstet, um einen Teil des Eisensulfids in Eisenoxid umzuwandeln. Anschließend werden Silikate und Koks dazugegeben, um das Eisenoxid als Eisensilikat zu verschlacken. Gleichzeitig bildet sich der Kupfer-Nickel-Rohstein aus Nickel-, Kupfer und Eisensulfid. Da dieser spezifisch schwerer als die Eisensilicat-Schlacke ist, können die beiden Phasen getrennt abgestochen werden.
Anschließend wird der Rohstein in einen Konverter gefüllt und Siliciumdioxid dazugegeben. Es wird Sauerstoff eingeblasen. Dadurch wird das restliche Eisensulfid zu Eisenoxid geröstet und danach verschlackt. Es entsteht der Kupfer-Nickel-Feinstein, der zu etwa 80 % aus Kupfer und Nickel und zu etwa 20 % aus Schwefel besteht.
Gewinnung von Rohnickel
Zur Gewinnung des Rohnickels muss das Nickel vom Kupfer abgetrennt werden. Dazu verschmilzt man den Feinstein mit Natriumsulfid Na2S. Dabei bildet sich nur zwischen Kupfer- und Natriumsulfid ein leicht schmelzendes Doppelsulfid. Es bilden sich zwei einfach zu trennende Phasen aus Kupfer-Natrium-Doppelsulfid (flüssig) und Nickelsulfid. Nach der Abtrennung wird das Nickelsulfid zu Nickeloxid geröstet und danach mit Koks zu Nickel reduziert.
Gewinnung von Rein- und Reinstnickel
Um Reinnickel zu gewinnen, wird das Rohnickel elektrolytisch raffiniert. Dazu wird in einer Elektrolysezelle das Rohnickel als Anode, ein Nickelfeinblech als Kathode geschaltet. Als Elektrolyt dient eine Nickelsalzlösung. Während der Elektrolyse gehen an der Anode Nickel und alle unedleren Bestandteile in Lösung. Alle edleren Bestandteile bleiben fest und fallen als Anodenschlamm unter die Elektrode. Dieser dient als wichtige Quelle für die Herstellung von Edelmetallen, wie Gold oder Platin. An der Kathode werden Nickelionen aus der Lösung zu Nickel reduziert, alle unedleren Bestandteile bleiben in Lösung. Die Reinheit von Elektrolytnickel beträgt rund 99,9 %.
Für die Gewinnung von Reinstnickel mit einer Reinheit von 99,99 % gibt es als Spezialverfahren das Mond-Verfahren, benannt nach Ludwig Mond, der 1890 Nickeltetracarbonyl entdeckte. Dieses Verfahren beruht auf der Bildung und Zersetzung des Nickeltetracarbonyls. Dazu wird feinverteiltes Rohnickelpulver bei 80 °C in einen Kohlenmonoxidstrom gebracht. Dabei bildet sich gasförmiges Nickeltetracarbonyl. Dieses wird von Flugstaub befreit und in eine 180 °C heiße Zersetzungskammer geleitet. Darin befinden sich kleine Nickelkugeln. An diesen zersetzt sich das Nickeltetracarbonyl wieder zu Nickel und Kohlenmonoxid. Es entsteht dadurch sehr reines Nickel.
Eigenschaften
Physikalische Eigenschaften
Nickel ist ein silbrig-weißes Metall. Es ist hart, schmiedbar, duktil und lässt sich ausgezeichnet polieren. Nickel ist wie Eisen und Cobalt ferromagnetisch. Seine Curie-Temperatur beträgt 354 °C. Es gibt zwei Nickel-Modifikationen. α-Nickel liegt in einer hexagonal-dichtesten, β-Nickel in einer kubisch-dichtesten Kugelpackung vor, wobei β-Nickel die stabilere Modifikation ist. Die Dichte des Nickels beträgt 8,9 g/cm³, seine Härte 3,8 nach Mohs.
Chemische Eigenschaften
Nickel ist bei Raumtemperatur gegen Luft, Wasser, Salzsäure und Laugen sehr beständig. Verdünnte Säuren greifen Nickel nur sehr langsam an. Gegenüber konzentrierten, oxidierenden Säuren (Salpetersäure) tritt analog zum rostfreien Stahl Passivierung ein. Löslich ist Nickel in verdünnter Salpetersäure (ca. 10 bis 15 %-ig). Auch eine halbkonzentrierte Salpetersäure (ca. 30 %-ig) bewirkt noch merkliche Passivierung. Der häufigste Oxidationszustand ist +II, seltener werden -I, 0, +I, +III und +IV beobachtet. Im Nickeltetracarbonyl hat Nickel die Oxidationszahl 0. Nickel(II)-Salze lösen sich in Wasser unter Bildung von Aquakomplexen mit grünlicher Farbe.
Fein verteiltes Nickel reagiert mit Kohlenmonoxid bei 50 bis 80 °C zu Nickeltetracarbonyl, Ni(CO)4, einer farblosen, sehr giftigen Flüssigkeit. Diese dient als Zwischenprodukt zur Herstellung von reinstem Nickel nach dem Mond-Verfahren. Bei 180 bis 200 °C zerfällt Nickeltetracarboyl wieder in Nickel und Kohlenmonoxid.
Physiologie
Für Säugetiere bleibt die Essenzialität von Nickel umstritten, für Pflanzen und verschiedene Mikroorganismen ist sie durch Isolierung mehrerer Enzyme (z. B. Urease), die Nickel im aktiven Zentrum enthalten, sowie durch Nachweis von Mangelerscheinungen in nickelarmer Umgebung, die sich durch Zusatz von Ni(II)-Salzen beheben lassen, gesichert.
In der Elektrophysiologie werden Nickel-Ionen dazu verwendet, spannungsaktivierte Calciumkanäle zu blockieren.
Gesundheitliche Probleme
Nickel ist der häufigste Auslöser für Kontaktallergien: in Deutschland sind schätzungsweise 1,9 bis 4,5 Millionen Menschen gegen Nickel sensibilisiert.[3] Deswegen werden Metalle und Legierungen, die mit der Haut in Kontakt kommen, zunehmend seltener vernickelt.
Wenige gegen Nickel sensibilisierte Menschen (etwa 1 %) reagieren auch bei Verzehr von Speisen, die Nickel enthalten, mit einer allergischen Reaktion.[4]
Nach Meinung US-amerikanischer Ärzte leidet jedes vierte Kind unter fünf Jahren an einer Kontakt-Allergie [5].
Wirtschaftliche Bedeutung
Nickel wird als Metall in geringen Mengen benötigt, der größte Teil der Produktion geht in die Produktion von Nickellegierungen und nichtrostenden Stählen. Die Reserven an nach heutigen Gesichtspunkten abbauwürdigen Nickelvorkommen liegen zwischen 70 und 170 Millionen Tonnen. Gegenwärtig werden weltweit jährlich weit mehr als 1 Million Tonnen (2006: 1,340 Mio. Tonnen[6]) gefördert.
Verwendung als Metall
Reines Nickelmetall wird in feinverteilter Form als Katalysator bei der Hydrierung ungesättigter Fettsäuren verwendet. Auf Grund seiner chemischen Beständigkeit wird Nickel für Apparate im chemischen Labor und der chemischen Industrie verwendet (z. B. Nickeltiegel für Aufschlüsse). Aus Nickelmetall werden Nickellegierungen mit genau bekanntem Verhältnis (z. B. für Münzen) hergestellt.
Nickel dient als Überzugsmetall zum Korrosionsschutz („Vernickeln“) von Metallgegenständen: Wegen seiner vor Oxidation schützenden Eigenschaften werden Metalle (insbesondere Eisen) mittels galvanischer Technik für bestimmte technische Zwecke mit einer Nickelschicht überzogen.
Verwendung als Legierung
Nickel ist ein bedeutendes Legierungsmetall, das hauptsächlich zur Stahlveredelung verwendet wird. Der größte Teil des Nickels geht dorthin. Es macht Stahl korrosionsbeständig und erhöht seine Härte, Zähigkeit und Duktilität. Mit Nickel hochlegierte Stähle werden bei besonders korrosiven Umgebungen eingesetzt. Der Edelstahl V2A enthält 8 % Nickel neben 18 % Chrom, V4A (Markennamen Cromargan oder Nirosta) 11 % neben 18 % Chrom und 2 % Molybdän.
Weitere bekannte Nickellegierungen sind:
- Neusilber, eine Kupfer-Nickel-Zink-Legierung mit 10–26 % Nickelanteil, die besonders korrosionsbeständig ist und hauptsächlich für Bestecke und elektrotechnische Geräte verwendet wird.
- Konstantan, eine Legierung aus 55 % Kupfer und 45 % Nickel, die über einen großen Temperaturbereich einen annähernd konstanten spezifischen elektrischen Widerstand besitzt. Sie wird vor allem für genaue Widerstände verwendet.
- Monel, ebenfalls eine Kupfer-Nickel-Legierung mit etwa 65 % Nickel, 33 % Kupfer und 2 % Eisen, die sich durch besondere chemische Beständigkeit, unter anderem gegen Fluor auszeichnet. Sie wird deshalb für Fluor-Druckgasflaschen verwendet.
- Raney-Nickel, eine Nickel-Aluminium-Legierung, die ein wichtiger Katalysator für die Hydrierung organischer Verbindungen ist.
- Nickelbasis-Superlegierungen sind Legierungen speziell für den Einsatz bei hohen Temperaturen und unter korrosiven Medien. Sie finden zum Beispiel in Flugzeugturbinen und Gasturbinen von Kraftwerken Anwendung.
- Austenitisches Gusseisen mit Kugelgraphit, ein sphärolitisches Sondergusseisen mit bis zu 20% Nickel, für den Einsatz in korrosiver Umgebung und bei hohen Temperaturen
Nachweis
Die Nachweisreaktion für die in Wasser meist mit grüner Farbe löslichen Nickel(II)-salze wird in der quantitativen Analytik gravimetrisch sowie qualitativ im Kationentrenngang mit Dimethylglyoxim-Lösung (Tschugajews Reagens) durchgeführt. Nickelsalze werden zuvor gegebenenfalls durch Ammoniumsulfid als grauschwarzes Nickel(II)-sulfid ausgefällt und in Salpetersäure gelöst. Der spezifische Nachweis ist dann durch Reaktion mit Dimethylglyoxim in ammoniakalischer Lösung möglich. Dabei fällt das himbeerrote Bis(dimethylglyoximato)nickel(II) als Komplex aus:
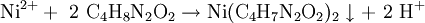 .
.Da Nickel aus ammoniakalischer Lösung mit Dimethylglyoxim quantitativ ausfällt, ist dieser Nachweis auch für die quantitative gravimetrische Nickelanalyse verwendbar. Aus ammoniakalischer Lösung kann auch mittels Elektrogravimetrie an einer Platinnetzelektrode eine quantitative Bestimmung erfolgen. Ähnlich anderen Schwermetallen wird Nickel heute meist durch Atomspektroskopie oder Massenspektrometrie auch im Ultraspurenbereich quantitativ bestimmt. Äußerst empfindlich ist die inverse Voltammetrie mit adsorptiver Anreicherung des Ni-Dimethyglyoxim-Komplexes an hängenden Quecksilbertropfen oder Quecksilberfilmelektroden.
Verbindungen
Nickel kommt in Verbindungen hauptsächlich in der Oxidationsstufe +II vor. Die Stufen 0, +I, +III und +IV sind selten und meist instabil. Nickel bildet eine Vielzahl meist farbiger Komplexe.
anorganische Nickelverbindungen
- Nickel(II)-chlorid NiCl2 ist ein gelber, stark hygroskopischer Feststoff, der als Farbstoff für Keramik und zur Herstellung von Nickelkatalysatoren dient. Neben der wasserfreien Form gibt es noch wasserhaltige Nickel(II)-chloride, z. B. das grüne Nickel(II)-chlorid-Hexahydrat, das aus wässrigen Nickelchloridlösungen auskristallisiert.
- Nickel(II)-hydroxid Ni(OH)2 und Nickel(III)-oxidhydroxid NiO(OH) werden zur Stromerzeugung in Nickel-Cadmium- und anderen Nickelakkumulatoren verwendet.
- Nickel(II)-oxid NiO und Nickel(III)-oxid Ni2O3 sind grüne beziehungsweise schwarze Feststoffe und werden zur Herstellung von Keramik, Gläsern und Elektroden verwendet. Außerdem werden sie als Katalysatoren für die Hydrierung organischer Verbindungen genutzt.
- Nickel(II)-nitrat Ni(NO3)2
- Nickel(II)-sulfat NiSO4 und Ammoniumnickel(II)-sulfat ((NH4)2Ni(SO4)2·6H2O) werden bei der Galvanisierung (Vernickelung) verwendet.
- Nickel(II)-carbonat NiCO3 wird als Pigment für keramische Erzeugnisse und zum Herstellen von Nickeloxid benutzt.
- Nickel(II)-sulfid NiS fällt aus ammoniakalischen, nicht jedoch aus sauren, nickelhaltigen Lösungen mit Ammoniumsulfid aus. Dadurch kann Nickel mit der Ammoniumsulfid-Gruppe im Kationentrennungsgang abgetrennt werden.
- Nickel(II)-cyanid Ni(CN)2 wird in der Metallurgie und Galvanoplastik verwendet.
- Nickel(II)-borat Ni(BO2)2 wird als Katalysator verwendet.
organische Nickelverbindungen
Nickeltetracarbonyl Ni(CO)4 ist eine farblose, sehr giftige Flüssigkeit. Sie ist ein wichtiges Zwischenprodukt im Mond-Verfahren. Nickeltetracarbonyl war die erste entdeckte Metallcarbonyl-Verbindung.
Nickelkomplexe
Nickel und dabei v. a. Nickel(II)-Ionen bildet viele, meist farbige Komplexe. Die Koordinationszahlen 6, 5 oder 4 sind am häufigsten. Bei schwachen, einzähnigen Liganden, beispielsweise Wasser, liegen sie meist als oktaedrische und paramagnetische High-spin-Komplexe mit Koordinationszahl 6 vor. Starke Liganden wie Cyanid bilden quadratisch-planare, diamagnetische Low-spin-Komplexe. Ebenfalls einen quadratisch-planaren Komplex bildet Dimethylglyoxim, da der Komplex zusätzlich durch Wasserstoffbrücken stabilisiert ist. Letzterer Bis(dimethylglyoximato)nickel(II)-Komplex ist für den nasschemischen Nickelnachweis von Bedeutung.
Anionische Nickelkomplexe enden auf "-niccolat".
Einzelnachweise
- ↑ Eintrag zu CAS-Nr. 7440-02-0 im European chemical Substances Information System ESIS
- ↑ L'état du monde 2005, annuaire économique géopolique mondial
- ↑ A. Schnuch u. a.: Epidemiology of contact allergy. An estimation of morbidity employing the clinical epidemiology and drug-utilization research (CE-DUR) approach. In: Contact Dermatitis 47, 2002, PMID 12225411, S. 32-39
- ↑ Jensen u. a.: Systemic contact dermatitis after oral exposure to nickel. A review with a modified meta-analysis. In: Contact Dermatitis. 54(2), 2006, PMID 16487279, S. 79-86
- ↑ Nickel, Thiomersal und Konsorten // Jedes vierte Kind unter fünf leidet an Kontakt-Allergie - aerztlichepraxis.de
- ↑ Handelsblatt: Nickelpreis bricht Rekorde. 10. April 2007
Literatur
- Eberhard Auer, Siegfried Müller, Rainer Slotta: 250 Jahre Nickel. Vom "nickel" zum "EURO". Verlag Deutsches Bergbau-Museum, Reihe Veröffentlichungen aus dem Deutschen Bergbau-Museum Bochum Bd. 95, Bochum 2001, ISBN 3-921533-81-3
- Arnold F. Holleman, Egon Wiberg, Nils Wiberg: Lehrbuch der anorganischen Chemie. 102. stark umgearbeitete und verbesserte Auflage, Verlag de Gruyter, Berlin [u.a.] 2007, ISBN 978-3-11-017770-1
- Harry H. Binder: Lexikon der chemischen Elemente - das Periodensystem in Fakten, Zahlen und Daten. Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3
Weblinks
- Mineralienatlas:Nickel (Wiki)
- Seilnacht.com: Nickel
- Reinstnickel >=99,9 % als Bild in der Sammlung von Heinrich Pniok
- Nickelpreisentwicklung als Diagramm (englisch)
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga As Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase
Wikimedia Foundation.