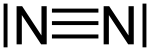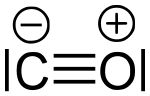- Dreifachbindung
-
Eine Dreifachbindung ist eine Form der chemischen Bindung zwischen „zwei“ Atomen, die über Elektronenpaare vermittelt wird (→ Elektronenpaarbindung). Zwischen den Atomen gewährleisten drei Paare von Bindungselektronen den Zusammenhalt des darauf aufbauenden Moleküls.
Inhaltsverzeichnis
Reaktivität von Dreifachbindungen
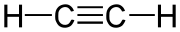 Kohlenstoff-Kohlenstoff-Dreifachbindungen am Beispiel von Ethin
Kohlenstoff-Kohlenstoff-Dreifachbindungen am Beispiel von Ethin
Eine Dreifachbindung hat somit eine sehr hohe Elektronendichte und sollte daher leicht elektrophile Additionsreaktionen eingehen. Im Fall von Kohlenstoff-Kohlenstoff-Dreifachbindungen trifft dies auch zu. Eine wesentliche Rolle spielt hierbei, dass C–C-Dreifachbindungen relativ energiereicher sind als C–C-Doppel- oder Einfachbindungen (Bei der Bildung einer Dreifachbindung werden durchschnittlich 811 kJ·mol−1 frei, für jede Doppelbindung 615 kJ·mol−1 und für jede Einfachbindung 345 kJ·mol−1).[1] Dadurch wird ersichtlich, dass die Energieabgabe bei der Entstehung von drei einzelnen Bindungen anstelle einer einzigen Dreifachbindung höher ist. Die Differenzen werden in den meisten Fällen leicht durch die neu entstehenden Bindungen aufgebracht, und es resultiert üblicherweise ein beträchtlicher Energiegewinn bei Additionen an C–C-Dreifachbindungen.
Beim Stickstoff sind die Verhältnisse genau umgekehrt. Die Dreifachbindung im Stickstoffmolekül N2 ist mit einer Bindungsenergie von 945 kJ·mol-1 relativ sehr viel energieärmer (=stabiler) als eine N-N-Doppelbindung (bei deren Bildung 466 kJ·mol−1) oder gar eine Einfachbindung (bei deren Bildung nur 159 kJ·mol−1 frei wird)[1]. Dadurch wird ersichtlich, dass die Energieabgabe bei der Entstehung von drei einzelnen Bindungen anstelle einer einzigen Dreifachbindung niedriger ist. Diese Energieunterschiede können normalerweise nicht über die Bildung zusätzlicher Bindungen mit den Reaktionspartnern aufgebracht werden, und daher ist molekularer Stickstoff ein bekanntes Beispiel für das Auftreten einer starken Dreifachbindung mit hoher Stabilität und trägem Reaktionsverhalten. Die höchste Bindungsenergie (1077 kJ·mol−1)[1] einer Dreifachbindung hat das Molekül Kohlenmonoxid (CO), da hier zusätzlich zur Dreifachbindung eine schwache ionische Bindung dazukommt.
Orbitalmodell der Dreifachbindung
Aus quantenchemischer Sicht kommen Bindungen durch Überlappung von Atomorbitalen zu einem Molekülorbital zustande. Die geläufigste Beschreibung der Dreifachbindung in Alkinen ist über eine Sigma-Bindung aus sp-Hybridorbitalen, die zwischen der Kernverbindungsachse liegt und zwei Pi-Bindungen, die untereinander einen Winkel von 90 Grad bilden und beide außerhalb der Kernverbindungsachse liegen. Eine alternative, vollkommen äquivalente Beschreibung benutzt drei gleichwertige „Bananenbindungen“, die durch Überlappung von sp3-Hybridorbitalen gebildet werden.
Alkine
Moleküle, die C–C-Dreifachbindungen enthalten, gehören der Molekülklasse der Alkine an. Die Chemie der Alkine ist durch Additionen von Elektrophilen an diese Bindung gekennzeichnet. Ein an einer Dreifachbindung beteiligtes Kohlenstoffatom ist sp-hybridisiert, daher sind Alkinanionen entsprechend stabil und als Nukleophile einsetzbar. Die Bindungslänge einer C–C-Dreifachbindung in Alkinen beträgt 120 pm.
Bindungslänge nach Pauling
Kovalente Bindungslängen können nach Pauling als Summe zweier Atomradien abgeschätzt werden. Auf der Grundlage von experimentellen und quantenchemischen Daten wurden additive Kovalenzradien für Atome in Dreifachbindungen für die Elemente Be bis 112 („Eka-Quecksilber“) veröffentlicht.[2] Der verwendete Datensatz ist selbstkonsistent und enthält nur einen Radius für alle Oxidationszustände und Koordinationszahlen der berücksichtigten Elemente. Durch einfaches Addieren der Atomradien kann eine Vorhersage über die Dreifachbindungslänge gemacht werden.[3]
Einzelnachweise
- ↑ a b c Arnold Frederik Holleman, Egon Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. De Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- ↑ Pekka Pyykkö, Sebastian Riedel, Michael Patzschke: Triple-Bond Covalent Radii. In: Chemistry. A European Journal. 11, Nr. 12, 2005, S. 3511–3520 (doi:10.1002/chem.200401299).
- ↑ Alle weiteren Daten können über die folgende Referenz abgefragt werden: http://www.psichem.de/triple-bond/index.htm
Siehe auch
MehrfachbindungenDoppelbindung | Dreifachbindung | Vierfachbindung | Fünffachbindung
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Dreifachbindung — Drei|fach|bin|dung: in chem. Verb. zwischen zwei gleich oder verschiedenartigen Atomen bestehende chemische stark ↑ ungesättigte Bindung, die in Valenzstrichformeln durch drei parallele Striche dargestellt wird, die eine Sigma u. zwei Pi… … Universal-Lexikon
Dreifachbindung — trilypis ryšys statusas T sritis fizika atitikmenys: angl. triple bond vok. Dreifachbindung, f rus. тройная связь, f pranc. liaison triple, f … Fizikos terminų žodynas
Alkin — Allgemeine Strukturformel eines Alkins mit einer endständigen Dreifachbindung; für Ethin ist n=0 Alkine sind ungesättigte Kohlenwasserstoffverbindungen, die in ihrer Kohlenstoffkette eine C≡C Dreifachbindung enthalten, welche die hohe… … Deutsch Wikipedia
Homologe Reihe der Alkine — Allgemeine Strukturformel eines Alkins mit einer endständigen Dreifachbindung; für Ethin ist n=0 Alkine sind ungesättigte Kohlenwasserstoffverbindungen, die in ihrer Kohlenstoffkette eine C≡C Dreifachbindung enthalten, welche die hohe… … Deutsch Wikipedia
Alkine — Allgemeine Strukturformel eines Alkins mit einer endständigen Dreifachbindung; für Ethin ist n=0 Alkine sind ungesättigte Kohlenwasserstoffverbindungen, die in ihrer Kohlenstoffkette eine C≡C Dreifachbindung enthalten, welche die hohe… … Deutsch Wikipedia
Acetylen — Strukturformel Allgemeines Name Ethin Andere Namen Acetylen Azetylen … Deutsch Wikipedia
Azetylen — Strukturformel Allgemeines Name Ethin Andere Namen Acetylen Azetylen … Deutsch Wikipedia
C2H2 — Strukturformel Allgemeines Name Ethin Andere Namen Acetylen Azetylen … Deutsch Wikipedia
Dissousgas — Strukturformel Allgemeines Name Ethin Andere Namen Acetylen Azetylen … Deutsch Wikipedia
Gerüstformel — Die Skelettformel des Antidepressivums Escitalopram mit Skelettdarstellung von Heteroatomen, einer Dreifachbindung, Benzolringen und Stereochemie. Die Skelettformel (auch Gerüstformel) einer or … Deutsch Wikipedia