- Fettsäurebiosynthese
-
Die biologische Fettsäuresynthese, auch als Lipogenese bezeichnet, verläuft durch sukszessiven Anbau von Malonyl-CoA an ein initiales Acetyl.
Im Gegensatz zum Abbau der Fettsäuren, der β-Oxidation, welcher sich in der Mitochondrienmatrix abspielt, findet deren Aufbau bei Tieren und Pilzen im Cytosol statt.Inhaltsverzeichnis
Fettsäuresynthese bei Pflanzen
Bei Pflanzen läuft die Fettsäurensynthese nur in den Plastiden ab. Bei grünen Pflanzenzellen in den Chloroplasten, sonst in den Chromoplasten, Leucoplasten oder Proplastiden. Es laufen dieselben Reaktionen wie im Cytosol ab, jedoch werden nur Fettsäuren bis C18 synthetisiert. Diese können maximal eine Doppelbindung durch eine lösliche Desaturasen des Stromas erhalten. Nach Transport ins glatte Endoplasmatische Retikulum erfolgt die Kettenverlängerung, im sER können durch membrangebundene Desaturase weitere Doppelbindungen eingebaut werden. Der Abbau der Fettsäuren erfolgt bei Pflanzen nicht in den Mitochondrien, sondern nur in Peroxisomen.
allgemeiner Reaktionsablauf
Für die genaue Biosynthese inklusive Strukturformeln siehe Abschnitt Weblinks
Bemerkenswert ist, dass die in Bau befindliche Fettsäure bei Säugetieren und Pilzen bis zur endgültigen Fertigstellung an einem multifunktionellem Enzym, der sogenannten Fettsäure-Synthase[1], gebunden bleibt, die alle sieben Enzymfunktionen trägt. Sie besitzt eine (distale) SH-Gruppe und eine (proximale) SH-Gruppe an einer Untereinheit des Komplexes, dem Acyl-Carrier-Protein (ACP).
Die Reaktionsfolge läuft wie folgt ab:
- 1) Bindung eines Moleküls Acetyl-CoA an der distalen SH-Gruppe durch die Acetyl-Transferase[2], Coenzym A wird abgespalten
- 2)
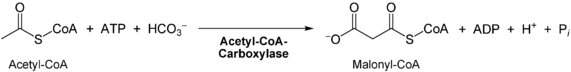
- Carboxylierung (Anlagerung von CO2) von freiem Acetyl-CoA zu Malonyl-CoA außerhalb des Komplexes durch die Acetyl-CoA-Carboxylase[3] (mit der prosthetischen Gruppe Biotin)
- 3) Bindung des Malonyl-CoA an die proximale SH-Gruppe des Enzymkomplexes durch die Malonyl-Transferase[4], dabei wird Coenzym A wieder abgespalten
- 4)
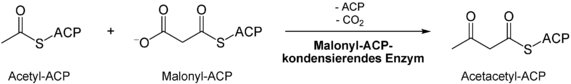
- Acetylrest kondensiert unter Abspaltung von CO2 mithilfe der Ketoacyl-Synthase[5] an den Malonylrest, es bildet sich eine Acetoacetylgruppe (C4) an der proximalen SH-Gruppe; mit jeder der acht „Zyklen“, die die Reaktion durchläuft, bekommt dieses Zwischenprodukt mehr C-Atome (hat folglich auch einen anderen Namen)
- 5)
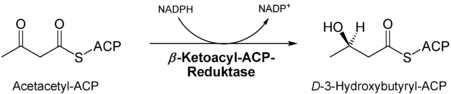
- Reduktion der Keto-Gruppe des Ketoacylrests an C3 durch die Ketoacyl-ACP-Reduktase[6], das Produkt ist ein Hydroxyacylrest
- 6)
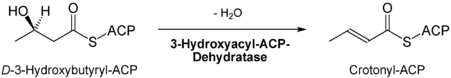
- Dehydratisierung des Hydroxyacylrests durch die Hydroxyacyl-ACP-Dehydratase[7] zwischen C2 und C3
- 7)
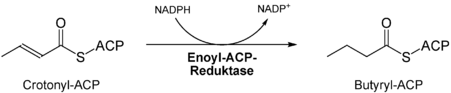
- Zweite Reduktion der Doppelbindung durch die Enoyl-ACP-Reduktase[8]
- 8) Anlagerung von Malonyl-CoA an die distale SH-Gruppe => sechsmalige Wiederholung des Zyklus' und damit Verlängerung des Acylrests an der proximalen SH-Gruppe
- 9) Palmitinsäure, C16 wird durch eine Acyl-Hydrolase freigesetzt und dissoziiert sofort zu Palmitat
Dieser Vorgang wiederholt sich bis zur Fertigstellung, wobei meistens Palmitinsäure durch eine Thiolase hydrolytisch abgespalten wird. Hierbei ist zu beachten, dass die Fettsäure zunächst frei vorliegt. Das Schlüsselenzym der Fettsäuresynthese ist die Acetyl-CoA-Carboxylase, die sowohl allosterisch als auch hormonell reguliert wird.
Die Kettenverlängerung der Fettsäuren wird in der Pflanze durch Elongasen katalysiert.
Dieser Stoffwechselweg spielt unter gewöhnlichen Nahrungsbedinungen jedoch eine geringe Rolle, da durch die Nahrung bereits genügend Fette aufgenommen werden. Infolgedessen besteht nicht die Notwendigkeit, aus Kohlenhydraten Fettsäuren aufzubauen. Bei Tieren hat die Fettsäuresynthese noch eine größere Rolle, da diese z. B. eine erhebliche Fettreserve für den Winter bilden müssen.
Siehe auch
- Fettsäureabbau (Beta-Oxidation)
Quellen
- ↑ EC 2.3.1.85 (Fettsäure-Synthase (MEC))
- ↑ EC 2.3.1.38 (ACP-S-Acetyltransferase)
- ↑ EC 6.4.1.2 (Acetyl-CoA-Carboxylase)
- ↑ EC 2.3.1.39 (ACP-S-Malonyltransferase)
- ↑ EC 2.3.1.41 (β-Ketoacyl-ACP-Synthase I)
- ↑ EC 1.1.1.100 (3-Ketoacyl-ACP-Reduktase)
- ↑ EC 4.2.1.61 (3-Hydroxypalmitoyl-ACP-Hydratase)
- ↑ EC 1.3.1.10 (Enoyl-ACP-Reduktase)
Literatur
- Biochemie des Menschen, Florian Horn e.a., 3. Auflage, Thieme Verlag 2005, ISBN 3-13-130883-4
- Biochemie, Berg/Tymoczko/Stryer, 5. Auflage, Spektrum Akademischer Verlag GmbH Heidelberg 2003, ISBN 3-8274-1303-6
- Lehrbuch der Botanik, Strasburger et.al., 35. Auflage, Spektrum Akademischer Verlag GmbH Heidelberg 2002, ISBN 3-8274-1010-X
Weblinks
- Animation des Reaktionsablaufs
- Gopinathrao/reactome.org: Fatty Acyl-CoA Biosynthesis
Wikimedia Foundation.
