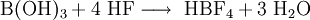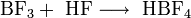- Fluorborsäure
-
Strukturformel 
Allgemeines Name Tetrafluorborsäure Andere Namen - Fluorborsäure
- Borfluorwasserstoffsäure
Summenformel HBF4 CAS-Nummer 16872-11-0 PubChem 28118 Kurzbeschreibung farblose wässrige Lösung [1] Eigenschaften Molare Masse 87,81 g·mol−1 Aggregatzustand flüssig
Dichte 1,40 g·cm−3 [1]
Schmelzpunkt Siedepunkt 130 °C (Zersetzung) [1]
Löslichkeit mischbar mit Wasser [1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Ätzend (C) R- und S-Sätze R: 34 S: (1/2)-26-27-45 WGK 1 [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Tetrafluorborsäure ist eine anorganische Säure. Ihr Anion ist das Tetrafluoroboration (BF4−). Sie ist kommerziell als 45–50%ige Lösung erhältlich.
Inhaltsverzeichnis
Darstellung
Als großtechnische Synthese von Tetrafluorborsäure wird die Reaktion von Borsäure mit 50%iger Flusssäure genutzt.
Eine weitere Möglichkeit besteht in der Umsetzung von Bortrifluorid mit Fluorwasserstoffsäure.[3]
Eigenschaften
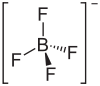
Tetrafluorborsäure ist nur in Lösung stabil. Die wässrige Lösung ist farblos und kann bis zu einer Konzentration von etwa 50 % konzentriert werden. Geometrisch ist das Boratom tetraedrisch von vier Fluoratomen umgeben und bildet einen kugelförmiges Anion. Tetrafluorborsäure besitzt einen pKs-Wert von −0,4. In wässriger Lösung liegt sie als Oxoniumsalz [H3O+][BF4−] vor.
Verwendung
Tetrafluorborsäure kann zur Synthese fluorierter Aromaten verwendet werden. Hierzu werden in einer Schiemann-Reaktion, einer Variante der Sandmeyer-Reaktion, Diazoaryle mit Tetrafluorborsäure umgesetzt. Des Weiteren kann sie zur Abspaltung der Boc-Schutzgruppe und als Katalysator für Polymerisationen eingesetzt werden. Tetrafluoroborat-Ionen sind schwach koordinierende Anionen. Ihre Salze können daher ihre Anionen leicht gegen stärker komplexierende austauschen und werden aus diesem Grund oft zur Herstellung anderer Salze verwendet. Bis vor einigen Jahren fand die Tetrafluorborsäure verbreitet Einsatz als Basis für saure Zinnelektrolyte. Durch den zwangsläufig entstehenden Anteil an Fluorid bzw. Flusssäure entsteht durch diese Elektrolyte jedoch ein Entsorgungsproblem. Daher finden sich heute meist Elektrolyte auf Basis von Methansulfonsäure oder Schwefelsäure.
Quellen
- ↑ a b c d e f Eintrag zu Tetrafluorborsäure in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 14.02.2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 16872-11-0 im European chemical Substances Information System ESIS
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 221-2.
- Holleman-Wiberg: Lehrbuch der Anorganischen Chemie 101. Auflage, de Gruyter, Berlin, 1995
Wikimedia Foundation.