- Glycerin-3-Phosphat-Shuttle
-
Das Glycerin-3-Phosphat-Dihydroxyacetonphosphat-Shuttlesystem ist ein biochemischer Transport-Mechanismus, der dazu dient, das bei der Glycolyse anfallende Reduktionsäquivalent Nicotinamidadenindinukleotid (NADH) vom Cytosol der Zelle, wo die Glycolyse abläuft, in die Matrix der Mitochondrien zu befördern, wo es über die Atmungskette zur Erzeugung von Adenosintriphosphat (ATP) genutzt werden kann. Dieser Shuttle läuft wesentlich schneller als der Malat-Aspartat-Shuttle und wird daher primär in Muskelzellen und im Gehirn verwendet, wo die Energie schnell verfügbar sein muss.
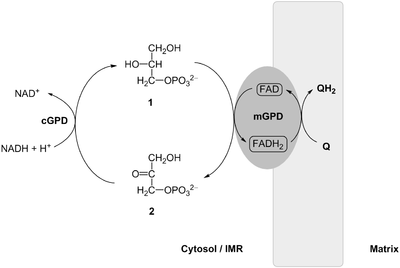
Die innere Membran der Mitochondrien ist für NADH nicht durchlässig (permeabel), ebenso nicht für ATP, ADP und Protonen. Weil aber während der Glycolyse ständig NADH und H+ aus NAD+ gebildet wird und dieser Prozess in den Mitochondrien beim Citratzyklus umgekehrt abläuft, wird über einen sogenannten Shuttle-Prozess gesichert, dass die im NADH und H+ gespeicherten Protonen (H+) und Elektronen in die Mitochondrien transportiert werden. Nur so ist ein Ausgleich der Reduktionsäquivalente zwischen Cytosol und Mitochondrien möglich.
Inhaltsverzeichnis
Vorkommen
Das Glycerin-3-Phosphat-Dihydroxyacetonphosphat-Shuttlesystem wurde in Tieren, Pilzen[1] und auch Pflanzen gefunden.[2]
Mechanismus
Zu diesem Zweck wird im Cytosol Dihydroxyacetonphosphat (DHAP) zu Glycerin-3-Phosphat reduziert. Dabei wird NADH und H+ zu NAD+ oxidiert. Diese Reaktion wird von einer löslichen, cytosolischen Glycerin-3-Phosphat-Dehydrogenase[3] katalysiert. In einem zweiten Schritt wird an der mitochondrialen Membran das Glycerin-3-Phosphat wieder zu Dihydroxyacetonphosphat oxidiert. Die dabei wieder freiwerdenden Elektronen und Protonen werden auf enzymgebundenes Flavin-Adenin-Dinukleotid (FAD) übertragen, das dadurch zu FADH2 reduziert wird. Diese Reaktion katalysiert eine membrangebundene, mitochondriale Glycerin-3-Phosphat-Dehydrogenase[4]. Dieses FADH2 wird wieder zu FAD oxidiert, wobei dabei Ubichinon der inneren Mitochondrienmembran reduziert wird. Letzteres gibt die Elektronen in der Atmungskette weiter.
Der Komplex I der Atmungskette wird bei diesem Shuttle übergangen, so dass in der Bilanz pro FADH2 nur 1,5 Einheiten ATP gebildet werden (bei NADH und H+ sind es 2,5). Bei Benutzung dieses Transportsystems im Gegensatz zum Malat-Aspartat-Shuttle ist die Energieausbeute aus der kompletten Oxidation eines Moleküls Glukose daher etwas geringer, sie beträgt statt durchschnittlich 32 ATP nur 30 ATP.
Quellen
- ↑ Ansell, R. et al. (1997): The two isoenzymes for yeast NAD+-dependent glycerol 3-phosphate dehydrogenase encoded by GPD1 and GPD2 have distinct roles in osmoadaptation and redox regulation. In: EMBO J. 16(9); 2179–2187; PMID 9171333; PDF (freier Volltextzugriff, engl.)
- ↑ Shen, W. et al. (2006): Involvement of a glycerol-3-phosphate dehydrogenase in modulating the NADH/NAD+ ratio provides evidence of a mitochondrial glycerol-3-phosphate shuttle in Arabidopsis. In: Plant Cell 18(2); 422–441; PMID 16415206; PDF (freier Volltextzugriff, engl.)
- ↑ 1.1.1.8 cytosolische NAD+-abhängige G-3-P-dehydrogenase (cGPD)
- ↑ 1.1.99.5 mitochondriale FAD-abhängige G-3-P-dehydrogenase (mGPD)
Siehe auch
Wikimedia Foundation.