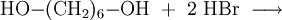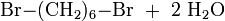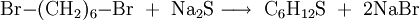- Hexamethylenbromid
-
Strukturformel 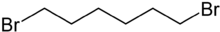
Allgemeines Name 1,6-Dibromhexan Andere Namen Hexamethylenbromid
Summenformel C6H12Br2 CAS-Nummer 629-03-8 PubChem 12368 Kurzbeschreibung farblose Flüssigkeit[1] Eigenschaften Molare Masse 243,98 g·mol−1 Aggregatzustand flüssig
Dichte 1,61 g·cm−3 (20 °C)[1]
Schmelzpunkt −2 °C[1]
Siedepunkt 243 °C[1]
Löslichkeit praktisch unlöslich in Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Gesundheits-
schädlichUmwelt-
gefährlich(Xn) (N) R- und S-Sätze R: 22-34-51/53 S: 24-37-61 WGK 2[2] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 1,6-Dibromhexan ist eine chemische Verbindung. Es handelt sich um ein Derivat des Hexans, das an den beiden terminalen Kettengliedern jeweils ein Bromatom trägt.
Inhaltsverzeichnis
Herstellung
1,6-Dibromhexan kann in einer Substitutionsreaktion aus 1,6-Hexandiol mit Bromwasserstoffsäure hergestellt werden.[3]
Eigenschaften
1,6-Dibromhexan ist eine farblose Flüssigkeit, die einen Schmelzpunkt von −2 °C und einen Siedepunkt von 243 °C besitzt. Der Brechungsindex bei einer Wellenlänge von 589 nm bei 20 °C beträgt 1,5307.[4]
Verwendung
Die Bromatome der Verbindung stellen Abgangsgruppen dar. Durch Substitutionsreaktionen an diesen Positionen können so weitere Hexanderivate erhalten werden. Auch die Bildung von Derivaten Hexenderivaten durch Eliminierungsreaktionen ist möglich.
1,6-Dibrompropan kann analog 1,6-Diiodhexan[5] zur Synthese von Thiepan verwendet werden. Hierzu wird es mit Natriumsulfid zur Reaktion gebracht.[6]
Quellen
- ↑ a b c d e f Eintrag zu CAS-Nr. 629-03-8 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 29. Juni 2008 (JavaScript erforderlich)
- ↑ Sicherheitsdatenblatt Merck.
- ↑ A. Müller, A. Sauerwald: Neue Synthese des 1,6-Dibrom-n-hexans und seine Einwirkung auf p-Toluolsulfamid, in: Monatsh. Chem. 1927, 48, 521–527.
- ↑ W. E. Vaughan, F. F. Rust, T. W. Evans: The Photo-Addition of hydrogen bromide to olefinic bonds, J. Org. Chem. 1942, 7, 477–490.
- ↑ J. v. Braun: Über cyclische Sulfide, in: Chem. Ber. 1910, 43, 3220–3226.
- ↑ A. Singh, A. Mehrotra, S. L. Regen: High Yield Medium Ring Synthesis of Thiacycloalkanes, in: Synth. Commun. 1981, 11, 409–412.
Wikimedia Foundation.