- Kritische Dichte
-
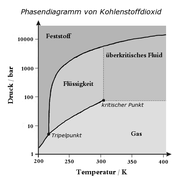
In der Thermodynamik ist der kritische Punkt ein thermodynamischer Zustand eines Stoffes, der sich durch Angleichen der Dichten von flüssiger und Gasphase kennzeichnet. Die Unterschiede zwischen beiden Aggregatzuständen hören an diesem Punkt auf zu existieren. Im Phasendiagramm stellt der Punkt das obere Ende der Dampfdruckkurve dar.
Inhaltsverzeichnis
Charakterisierung
Der kritische Punkt ist durch drei Zustandsgrößen ausgezeichnet,
- die kritische Temperatur Tc,
- den kritischen Druck pc und
- die kritische Dichte ρc beziehungsweise auch das kritische Molvolumen Vm, c.
Die kritische Temperatur ist die Temperatur, unterhalb der ein Gas durch Druck verflüssigt werden kann; oberhalb der kritischen Temperatur ist dies nicht mehr möglich.
Da oberhalb des kritischen Punktes Flüssigkeit und Gas nicht mehr voneinander unterschieden werden können, spricht man stattdessen von einem überkritischen Fluid oder einem überkritischen Zustand (selten auch superkritisch nach dem englischen supercritical).
Bei Annäherung an den kritischen Punkt nähern sich die Dichte des gasförmigen Zustands, sie steigt mit der Temperatur, und des flüssigen Zustands, sie sinkt durch die Wärmeausdehnung, einander an. Die Verdampfungswärme sinkt bei der Annäherung und verschwindet beim Erreichen ganz. Knapp unterhalb des kritischen Punktes kann man das Phänomen der kritischen Opaleszenz beobachten: Aufgrund der extrem niedrigen Verdampfungswärme wechseln Teile der Substanz ständig zwischen flüssigem und gasförmigen Zustand hin und her, was sich durch eine starke Schlierenbildung äußert.
Atomistisch lässt sich das Verhalten jenseits des kritischen Punkts anschaulich beschreiben: Wird ein Gas einem immer höheren Druck ausgesetzt, so verringern sich die Abstände zwischen den Gasmolekülen kontinuierlich. Bei Erreichen des kritischen Drucks werden die Abstände dann genau so groß wie zwischen den Molekülen in der flüssigen Phase; es ist kein Unterschied mehr feststellbar.
Experimentelle Beobachtung
Der Übergang in einen überkritischen Zustand lässt sich gut an Kohlenstoffdioxid (CO2) beobachten, das in einem dickwandigen Rohr aus Quarzglas unter Druck eingeschlossen ist. Die kritische Temperatur von CO2 beträgt 31,0 °C, der kritische Druck 73,8 bar.
Bei einer Temperatur unter 31 °C ist das Rohr zum Teil mit flüssigem CO2, zum anderen Teil mit gasförmigem CO2 gefüllt. Beide Phasen sind farblos, klar durchsichtig und durch die deutlich sichtbare Flüssigkeitsoberfläche (Phasengrenzfläche) getrennt. Wird das Rohr in ein Wasserbad von etwa 35 °C getaucht, so lässt sich beim Erwärmen zunächst eine Volumenzunahme der Flüssigkeit durch thermische Ausdehnung beobachten, während das Volumen des Dampfes infolge Kompression abnimmt. Hat das CO2 die kritische Temperatur von 31 °C erreicht, so bildet sich kurzzeitig ein dichter Nebel (kritische Opaleszenz), der sich nach wenigen Sekunden weiterer Erwärmung wieder auflöst. Das Rohr ist danach mit einer einzigen homogenen, klar durchsichtigen Phase gefüllt: überkritisches CO2. Beim Abkühlen tritt wieder kurzzeitig Nebel auf, bevor sich das CO2 in eine flüssige und eine gasförmige Phase teilt.
Abschätzung und Berechnung
Die kritischen Zustandsgrößen können neben einer vergleichsweise aufwendigen empirischen Messung auch aus der Van-der-Waals-Gleichung abgeschätzt werden, wobei man sie hier auch zur Definition der Reduzierten Größen nutzt.
Neben diesen Zustandsgleichungen werden häufig auch Gruppenbeitragsmethoden wie etwa die Lydersen-Methode verwendet, mit denen die kritischen Größen aus der Molekülstruktur bestimmt werden.
Entdeckung
Durch die zunehmende Verwendung von Dampfmaschinen in der Industrie im 18. Jahrhundert wurde zur gleichen Zeit auch die Untersuchung des Siedeverhaltens verschiedener Stoffe für die Wissenschaft von Interesse. Es stellte sich heraus, dass die Siedepunktstemperatur mit steigendem Druck auch ansteigt. So nahm man an, dass die Koexistenz von Flüssigkeit und Gas bis zu beliebig hohen Drücken möglich sei.
Diese Annahme wurde um 1860 von dem irischen Physiker und Chemiker Thomas Andrews widerlegt. Anhand von Untersuchungen mit CO2 konnte er zeigen, dass es einen Punkt gibt, ab dem der Unterschied zwischen Gas und Flüssigkeit nicht mehr existent ist und der sich durch eine bestimmte Temperatur, einen bestimmten Druck und eine bestimmte Dichte auszeichnet. Diesen Punkt nannte er den „Kritischen Punkt“. Kurz darauf gab der niederländische Physiker Johannes Diderik van der Waals eine plausible Erklärung (siehe oben) für das Verhalten von Stoffen im überkritischen Bereich.
Anwendungen
Überkritische Fluide kombinieren das hohe Lösevermögen von Flüssigkeiten mit der niedrigen Viskosität ähnlich den Gasen. Weiterhin verschwinden sie bei Druckminderung vollständig (verdampfen). Somit eignen sie sich als ideale Lösungsmittel, welche als Nachteile lediglich den hohen Druck während des Prozesses aufweisen. Überkritische Fluide werden auch zum Erzeugen von feinsten Partikeln eingesetzt.
In überkritischem Wasser kann SiO2 gelöst werden. Beim Auskristallisieren am Impfkristall werden Quarzeinkristalle gebildet. Diese werden dann in kleine Stücke gesägt und in Quarzuhren eingesetzt.
Überkritisches Wasser löst Fette aus Fleisch heraus. Da sich viele verschiedene Substanzen im Fett ablagern, werden mit dieser Methode Medikamente und andere Substanzen aus dem Fleisch extrahiert und nachgewiesen.
Bei Textilfärbeanwendungen kann die gute Löslichkeit des Farbstoffes im überkritischen Zustand ausgenutzt werden, um den Farbstoff aufzunehmen und in die Faser zu übertragen. Nach Abschluss des Vorgangs wird die überkritische Flüssigkeit entspannt und der restliche Farbstoff fällt fest aus.
Eine Anwendung von überkritischem CO2 ist die Entfernung von Koffein aus Tee und Kaffee.
Siehe auch
Weblinks
Klassische Aggregatzustände:
Gas | Flüssigkeit | FestkörperNichtklassische Aggregatzustände:
Plasma | Bose-Einstein-Kondensat | Suprafluidität | Suprasolidität | mesomorpher Zustand | überkritischer Zustand | Atomgas
Wikimedia Foundation.