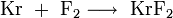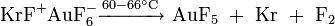- Krypton(II)-fluorid
-
Strukturformel 
Allgemeines Name Kryptondifluorid Andere Namen Krypton(II)-fluorid
Summenformel KrF2 CAS-Nummer 13773-81-4 PubChem 83721 Kurzbeschreibung farblose Kristalle Eigenschaften Molare Masse 121,79 g·mol−1 Aggregatzustand fest (nur bei tiefen Temperaturen bekannt)
Dichte 3,24 g·cm−3[1]
Schmelzpunkt Sublimation bei −60 °C[1]
Löslichkeit Zersetzung bei Kontakt mit Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kryptondifluorid ist eine chemische Verbindung bestehend aus Krypton und Fluor.
Physikalische Eigenschaften
Kryptondifluorid ist linear aufgebaut, der Bindungsabstand im gasförmigen Zustand beträgt 1,889 Å.[3]
Chemische Eigenschaften
Kryptondifluorid ist die einzige bekannte, kovalente Kryptonverbindung.[3] Sie ist höchst instabil und existiert nur bei Temperaturen unter −80 °C. Hergestellt wird es bei −196 °C mithilfe elektrischer Entladungen aus elementarem Krypton und Fluor in einer mit 60 kJ/mol endothermen Reaktion. Kryptondifluorid liegt dann als farblose, kristalline Substanz vor.
Kryptondifluorid ist ein starkes Oxidationsmittel, es kann Xenon in Xenonhexafluorid oder Iod in Iodpentafluorid überführen. Darüber hinaus ist es auch ein Fluroidionen-Donator.[3] Das Kation KrF+ ist das bisher stärkste bekannte Oxidationsmittel, stärker noch als Sauerstoffdifluorid und elementares Fluor. Es vermag als einzig bekannte Substanz Gold in die Oxidationsstufe +5 zu bringen:[4][3]
Ein anderes Beispiel einer nur bei tiefen Temperaturen stabilen Kryptonverbindung ist Kryptonbis(pentafluororthotellurat) Kr(OTeF5)2.
Quellen
- ↑ a b webelements.com/Kryptondifluorid
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c d Nils Wiberg, Egon Wiberg und Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. Gruyter Verlag; 102., stark umgearb. u. verb. Auflage 2007; ISBN 978-3-11-017770-1; S. 425
- ↑ James Huheey, Ellen Keiter, Richard Keiter : Anorganische Chemie: Prinzipien von Struktur und Reaktivität, 2003, Walter de Gruyter, ISBN 3-11-017903-2
Wikimedia Foundation.