- Plutonium(VI)-fluorid
-
Strukturformel 
Kristallsystem Raumgruppe 
Gitterkonstanten a = 995 pm
b = 902,0 pm
c = 526,0 pmAllgemeines Name Plutonium(VI)-fluorid Andere Namen Plutoniumhexafluorid
Summenformel PuF6 CAS-Nummer 13693-06-6 PubChem 518809 Kurzbeschreibung rotbrauner, kristalliner Feststoff[1]
Eigenschaften Molare Masse 358,06 g·mol−1 Aggregatzustand fest
Dichte 5,08 g·cm−3[1]
Schmelzpunkt Siedepunkt 62 °C[2]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [3] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Radioaktivität 
RadioaktivThermodynamische Eigenschaften ΔHf0 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Plutonium(VI)-fluorid (PuF6), meistens Plutoniumhexafluorid genannt, ist eine Verbindung aus den Elementen Plutonium und Fluor. Es ist ein rotbrauner kristalliner Feststoff, welcher leicht flüchtig, radioaktiv und korrosiv ist. In den meisten Fällen wird es aus Plutonium(IV)-fluorid (PuF4) durch Umsetzung mit elementarem Fluor (F2) gewonnen. Plutoniumhexafluorid spielt eine Rolle bei der Anreicherung von Plutonium, besonders für die Isolierung des reinen Isotops 239Pu, sowie bei der Trennung von Uran und Plutonium bei der Aufarbeitung nuklearer Abfälle.
Inhaltsverzeichnis
Geschichte
Schon recht bald nach der Isolierung von Plutonium wurde die Existenz von Plutoniumhexafluorid postuliert. Da die chemischen Eigenschaften von Uran und Plutonium große Ähnlichkeiten aufweisen, war davon auszugehen, dass auch die Eigenschaften von Plutoniumhexafluorid denen des schon bekannten Uranhexafluorids ähnlich sind, darunter auch die hohe Flüchtigkeit. Vorstudien begannen in den USA ab 1942 und führten zunächst zu widersprüchlichen Ergebnissen. Aufgrund des andauernden Zweiten Weltkriegs wurden die Arbeiten zunächst nicht veröffentlicht.
Brown und Hill, denen Plutonium in wenigen Mikrogramm zur Verfügung stand, schlossen 1942 aus Destillationsexperimenten mit Uranhexafluorid, dass höhere Fluoride des Plutoniums instabil sein würden und diese sich bei Raumtemperatur wieder zu Plutoniumtetrafluorid zersetzen. Ebenso zogen sie den Schluss, dass der Dampfdruck dieser Plutoniumverbindung dem des Uranhexafluorids entspricht.[5] Davidson, Katz und Orlemann stellten 1943 fest, dass sich Plutonium unter einer Fluoratmosphäre aus einem Nickelgefäß verflüchtigt und sich das Produkt auf einer Platinoberfläche niederschlägt.[6] Fisher, Vaslow und Tevebaugh vermuteten 1944, dass die Bildungsenthalpie der höheren Fluoride positiv ist, die Bildungsreaktion also endotherm ist, und diese daher nur bei höheren Temperaturen in einer Fluoratmosphäre stabil sein dürften.[7] Florin stellte 1944 eine flüchtige Verbindung des Plutoniums her, von der angenommen wurde, dass es sich um Plutoniumhexafluorid handelte. Das Produkt zersetzte sich aber, bevor es identifiziert werden konnte. Das flüchtige Material schlug sich zunächst auf Glas an einer kühleren Stelle nieder, nach einigen Minuten sank die Flüchtigkeit merklich, und das Material änderte seinen Aggregatzustand von fest nach flüssig. Man vermutete eine Reaktion des Fluorids mit der Glasoberfläche.[8] Um die Eigenschaften des Plutoniumhexafluorids vorherzusagen, verwendeten Brewer, Bromley, Gilles und Lofgren bereits bekannte thermodynamische Daten sowie weitere Angaben, die aus dem Vergleich von Uran- und Plutoniumverbindungen stammen.[9][10][11]
Die wesentlichen Ergebnisse lieferte Florin im Jahr 1950.[12][13] Genauere thermodynamische Daten sowie technische Verbesserungen der verwendeten Apparaturen wurden 1952 erarbeitet und 1953 zusammengefasst.[14][15] Vier britische Arbeiten folgten in den Jahren 1951 bis 1953.[16][17][18][19] Malm und Weinstock[20] sowie Hawkins, Mattraw und Sabol[21] steuerten weitere Ergebnisse bei. Die vorhergehenden Publikation wurden bis 1955 freigegeben und gemeinsam im Journal of Inorganic and Nuclear Chemistry im Jahr 1956 veröffentlicht.[22][23][24] Alle verfügbaren Daten bis zum Mai 1963 wurden von Steindler zusammengefasst.[25]
Darstellung
Die gängigste Methode zur Darstellung von Plutoniumhexafluorid ist die Umsetzung von Plutonium(IV)-fluorid (PuF4) mit elementarem Fluor (F2).[22][23][24]
Die Reaktion ist endotherm. Das Produkt bildet sich relativ schnell bei Temperaturen von 750 °C; hohe Ausbeuten können erreicht werden, wenn das PuF6 schnell kondensiert wird.[24]
Plutoniumhexafluorid wurde u. a. auch durch Fluorierung von Plutonium(III)-fluorid oder Plutonium(IV)-oxid dargestellt.[22]
Plutonium(III)-fluorid, Plutonium(IV)-oxalat bzw. Plutonium(IV)-oxid wurden jeweils in einem Gasstrom von Fluorwasserstoff und Sauerstoff bei etwa 700 °C umgesetzt; dies führte in allen Fällen zu einer vollständigen Verflüchtigung der Ausgangsstoffe zum Plutoniumhexafluorid.[16]
Plutoniumtetrafluorid wurde mit Sauerstoff bei 800 °C gleichfalls zu Plutoniumhexafluorid umgesetzt.[17]
Die Synthese gelingt hingegen schon bei Raum- bzw. niedrigeren Temperaturen mittels Kryptondifluorid (KrF2)[27] bzw. Disauerstoffdifluorid (O2F2)[28][29] sowie durch Bestrahlung mit UV-Licht.[30]
Eigenschaften
Physikalische Eigenschaften
Frisch bei −180 °C kondensiertes und im Vakuum verschlossenes Plutoniumhexafluorid ist anfänglich eine farblose kristalline Substanz, ähnlich dem Uranhexafluorid; beim Erwärmen auf Raumtemperatur ändert sich die Farbe auf rotbraun.[22] Unter Normaldruck (1.013,25 hPa) schmilzt es bei 52 °C und siedet bei 62 °C. Der Tripelpunkt, an dem die drei Phasen fest, flüssig und gasförmig im Gleichgewicht stehen, liegt bei einer Temperatur von 51,58 °C (324,74 K) bei einem Druck von 710 hPa (533 Torr),[2] d. h. dass unterhalb dieses Drucks festes Plutoniumhexafluorid beim Erwärmen durch Sublimation direkt in den gasförmigen Zustand übergeht. Die Flüchtigkeit von PuF6 ist ähnlich zu der von Uranhexafluorid (UF6) und Neptuniumhexafluorid (NpF6); sie gehören zusammen zu den drei bisher bekannten Hexafluoriden der Actinoidenelemente. Die Bildungsentropie (S0m) beträgt für festes PuF6: 221,8 ± 1,1 J·K−1·mol−1, für gasförmiges PuF6: 368,9 ± 1,0 J·K−1·mol−1.[4] Festes PuF6 ist leicht paramagnetisch.[24][31]
Kristall- und Molekülstruktur
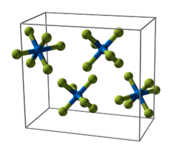
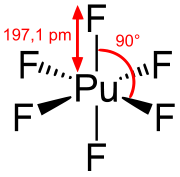
Plutoniumhexafluorid ist eine kovalente Verbindung und kein Salz. Es kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Pnma (D162h) mit den Gitterparametern a = 995 pm, b = 902,0 pm und c = 526,0 pm und vier Formeleinheiten pro Elementarzelle.[2] Die Molekular- und Kristallstrukturen von PuF6 entsprechen denen des UF6.[24] Im gasförmigen Zustand besteht es aus regulär oktaedrischen Molekülen (Oh) mit einheitlicher Pu–F-Bindungslänge von 197,1 pm.[32]
Spektroskopische Eigenschaften
Plutoniumhexafluorid besitzt sechs Grundschwingungen: ν1, ν2, ν3, ν4, ν5 und ν6. ν1 und ν2 sind Streckschwingungen, ν5 und ν6 sind Biegeschwingungen.[24][33][34][35] ν1, ν2 und ν5 sind Raman-aktiv, ν3 und ν4 IR-aktiv, ν6 ist IR- und Raman-inaktiv.[36][37] Das Raman-Spektrum von PuF6 konnte bislang nicht beobachtet werden, aufgrund der raschen photochemischen Zersetzung bei 564,1 nm.[21] Bei PuF6 ist eine Fluoreszenz zu beobachten, diese ist bei 532 nm und 1064 nm näher untersucht worden.[38][39]
-
Grundschwingung ν1 ν2 ν3 ν4 ν5 ν6 Termsymbol A1g Eg F1u F1u F2g F2u Wellenzahl (cm−1) (628) (523) 616 206,0 (211) (173) IR-aktiv – – × × – – Raman-aktiv × × – – × –
Chemische Eigenschaften
Plutoniumhexafluorid ist nicht brennbar, nicht explosiv und beständig gegen trockene Luft. Es reagiert hingegen sehr heftig mit Wasser (beispielsweise Luftfeuchtigkeit), wobei das wasserlösliche Plutonyl(VI)-fluorid (PuO2F2) und Fluorwasserstoff (HF) entstehen.[23][40]
Es kann sehr lange bei Raumtemperatur in Quarz- oder PYREX-Ampullen aufbewahrt werden, wenn sichergestellt ist, dass keine Spuren von Feuchtigkeit vorhanden sind, das Glas selbst von allen Gaseinschlüssen frei ist und eventuell vorhandener Fluorwasserstoff (HF) restlos entfernt wurde.[41]
Plutoniumhexafluorid zersetzt sich wiederum zu Plutonium(IV)-fluorid (PuF4) und elementarem Fluor (F2):
- Es ist eine merkliche thermische Zersetzung zum Plutonium(IV)-fluorid zu beobachten;[42][43][44][45] sie setzt bei Raumtemperatur noch nicht ein, läuft aber sehr rasch bei 280 °C ab.[24]
- Ferner unterliegt es der Autoradiolyse, d. h. der Zersetzung durch die eigene Radioaktivität, und bildet dabei ebenfalls Plutonium(IV)-fluorid und elementares Fluor.[46][25][47] Sobald sich emittierte α-Teilchen durch das Kristallgitter bewegen, werden Bindungen gebrochen und die Zersetzung von PuF4 zu F2 und den niederen Plutoniumfluoriden setzt ein. Die Zersetzungsrate durch α-Strahlung beim Isotop 239Pu beträgt durchschnittlich 1,5 % pro Tag in der festen Phase. Sie ist jedoch in der Gasphase deutlich kleiner.[24] Die beobachtete Abbaurate[31] von gasförmigen PuF6 ist keine lineare Funktion der Zeit, nimmt aber mit der Zeit ab, von 1,78 bis 0,064 % des ursprünglichen PuF6 (100 Torr) pro Tag in den Bereich von 0,5 bis 571 Tage bei 26 °C. Die anfängliche hohe Abbaurate von 1,78 % pro Tag kann zum Teil auf die Reaktion des PuF6 mit dem Behältermaterial zurückgeführt werden. Wenn der Druck des PuF6 von 100 auf 50 Torr abgesenkt wird, wird eine geringere Abbaurate beobachtet. In jahrzehntealten dichten PuF6-Zylindern wurde ein überraschend niedriger Gasdruck gemessen; es wurde angenommen, dass eine Rekombination mit F-Atomen stattfindet.[48] Plutoniumhexafluorid wird gleichfalls durch γ-Strahlung zersetzt.[49]
- NpF6 und PuF6 sind lichtempfindlich und zersetzen sich zu den Tetrafluoriden und Fluor.[41]
- Durch Bestrahlung mit einem CO2-Laser bei einer Wellenlänge unterhalb von 520 nm zersetzt es sich zu Plutonium(V)-fluorid (PuF5) und Fluor[50]; bei weiterer Bestrahlung erfolgt die Zersetzung zum Plutonium(IV)-fluorid.[51]
Vergleich der Actinoidenhexafluoride
Uranhexafluorid (UF6) entsteht relativ zügig bei 300 °C aus Urantetrafluorid (UF4) und Fluor (F2), in gleicher Weise entsteht NpF6 bei 500 °C aus Neptuniumtetrafluorid (NpF4) und F2 und PuF6 bei 750 °C aus Plutoniumtetrafluorid (PuF4) und F2. Americiumhexafluorid (AmF6) kann unter diesen Bedingungen nicht dargestellt werden.[41]
Verwendung
Plutoniumhexafluorid spielt u. a. eine Rolle bei der Anreicherung von Plutonium, besonders für die Isolierung von reinem 239Pu (Halbwertszeit: 24110 Jahre) aus bestrahltem Uran. Dieses isotopenreine Plutonium wird benötigt, um eine versehentliche vorzeitige Zündung von Nuklearwaffen zu verhindern. Das ansonsten als Verunreinigung anwesende 241Pu (Halbwertszeit: 14,35 Jahre) erzeugt durch Spontane Spaltung genügend Neutronen, um eine solche unkontrollierte Zündung auszulösen.
Die Trennung von Uran- und Plutoniumhexafluorid sind aktuelle Fragestellungen bei der Aufarbeitung nuklearer Abfälle.[52][53][54]
- Aus Salzschmelzen, die Uran und Plutonium enthalten, kann das Uran durch Fluorierung weitgehend als UF6 entfernt werden, da es bei hohen Temperaturen stabiler ist; nur wenig Plutonium entweicht dagegen als PuF6.[55]
- Eine Reduktion des Plutoniumhexafluorids wird u. a. durch physikalische Methoden erreicht, wie die Exploding-Wire-Methode: eine Bestrahlung mit einer Hochdruck-Quecksilber-Lampe, eine hohe intensive Funkenentladung und die Bestrahlung durch einen CO2-Laser.[56]
- Eine möglichst vollständige Reduktion von Plutoniumhexafluorid zum Plutoniumdioxid ist ebenfalls von Bedeutung. Reaktionen in einer Sauerstoff-Methan-Flamme zeigten, dass der Restgehalt an Fluor im entstandenen Oxid nur maximal 5·10−3 Massenprozent beträgt. Das in der Flamme entstehende Kohlenmonoxid ist ein gutes Reduktionsmittel, um die Dioxide der Actinoiden direkt aus den Hexafluoriden zu erhalten.[57]
Eine Trennung von Plutonium und darin enthaltenem Americium gelingt durch Reaktion mit Disauerstoffdifluorid (O2F2). Das als Verunreinigung vorhandene 241Pu (Halbwertszeit: 14,35 Jahre) zerfällt zu 241Am, so dass nach längerer Lagerung merkliche Mengen Americium entstehen, die entfernt werden müssen. Länger gelagertes PuF4 wird bei Raumtemperatur fluoriert, um PuF6-Gas zu erhalten, welches separat aufgefangen und wieder zu PuF4 reduziert wird. Das Reaktionsprodukt enthält nur noch wenig Americium, während der nicht umgesetzte feste Rückstand entsprechend erhöhte Konzentrationen hatte.[58]
Sicherheitshinweise
Einstufungen nach der Gefahrstoffverordnung liegen nicht vor, obwohl die chemische Giftigkeit bekannt ist. Wichtig sind die auf der Radioaktivität beruhenden Gefahren, sofern es sich um eine dafür relevante Stoffmenge handelt.
Literatur
- David L. Clark, Siegfried S. Hecker, Gordon D. Jarvinen, Mary P. Neu: Plutonium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 813–1264; doi:10.1007/1-4020-3598-5_7.
- N. P. Galkin, Yu N. Tumanov: „Reactivity and Thermal Stability of Hexafluorides“, in: Russ. Chem. Rev., 1971, 40 (2), S. 154–164; Abstract; doi:10.1070/RC1971v040n02ABEH001902.
- R. C. Burns, T. A. O'Donnell, C. H. Randall: „Reactivity of Transition Metal Fluorides – XII: Plutonium Hexafluoride“, in: Journal of Inorganic and Nuclear Chemistry, 1981, 43 (6), S. 1231–1238; doi:10.1016/0022-1902(81)80023-1.
Einzelnachweise
- ↑ a b CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 4, Properties of the Elements and Inorganic Compounds; Physical Constants of Inorganic Compounds, p. 4-81.
- ↑ a b c d e Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Transurane, Teil C, S. 108–114.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c David L. Clark, Siegfried S. Hecker, Gordon D. Jarvinen, Mary P. Neu: Plutonium, S. 1087.
- ↑ H. S. Brown, O. F. Hill: University of Chicago Metallurgical Laboratory Report CN-363; 12. November 1942.
- ↑ N. R. Davidson, J. J. Katz, O. F. Orlemann: University of Chicago Metallurgical Laboratory Report CK-987; 11. Oktober 1943.
- ↑ R. W. Fisher, F. Vaslow, A. D. Tevebaugh: Iowa State College, Report CN-1783; 10. August 1944.
- ↑ A. E. Florin: University of Chicago Metallurgical Laboratory Report CN-2159; 1. Oktober 1944.
- ↑ L. Brewer, L. Bromley, P. W. Gilles, N. L. Lofgren: University of California Radiation Laboratory Report CN-3300; 10. Oktober 1945.
- ↑ L. Brewer, L. Bromley, P. W. Gilles, N. L. Lofgren: University of California Radiation Laboratory Report CN-3378; 1. Dezember 1945.
- ↑ L. Brewer, L. A. Bromley, P. W. Gilles, N. L. Lofgren: „The Higher Fluorides of Plutonium“, UCRL-633 (20. März 1950); Abstract.
- ↑ Alan E. Florin: Plutonium Hexafluoride, Plutonium (VI) Oxyfluoride: Preparation, Identification, and Some Properties (Los Alamos Scientific Laboratory Reports LAMS-1118). Los Alamos Scientific Laboratory, 16. Oktober 1950, abgerufen am 1. Mai 2010.
- ↑ A. E. Florin: Plutonium Hexafluoride: Second Report On The Preparation and Properties (Los Alamos Scientific Laboratory Reports LA-1168). Los Alamos Scientific Laboratory, 9. November 1950, abgerufen am 1. Mai 2010.
- ↑ A. E. Florin: Thermodynamic Properties of Plutonium Hexafluoride: a Preliminary Report (Los Alamos Scientific Laboratory Reports LAMS-1587). Los Alamos Scientific Laboratory, 15. Mai 1953, abgerufen am 1. Mai 2010.
- ↑ I. R. Tannenbaum, A. E. Florin: An Improved Apparatus for the Preparation of Plutonium Hexafluoride (Los Alamos Scientific Laboratory Reports LA-1580). Los Alamos Scientific Laboratory, 15. Mai 1953, abgerufen am 1. Mai 2010.
- ↑ a b J. K. Dawson, A. E. Truswell: Atomic Energy Research Establishment Report A.E.R.E. C/R-662; 1951.
- ↑ a b C. J. Mandleberg, et al.: Atomic Energy Research Establishment Report A.E.R.E. C/R-157; 1952.
- ↑ C. J. Mandleberg, H. K. Rae, D. Davis, K. E. Francis: Atomic Energy Research Establishment Report A.E.R.E. C/R-1172; April 1953.
- ↑ R. Hurst, C. J. Mandleberg, H. K. Rae, D. Davis, K. E. Francis: Atomic Energy Research Establishment Report A.E.R.E. C/R-1312; Januar 1953.
- ↑ J. G. Malm, B. Weinstock: „Argonne Plutonium Hexafluoride Program“, Argonne National Laboratory Report ANL-5366 (1. September 1954); Abstract.
- ↑ a b N. J. Hawkins, H. C. Mattraw, W. W. Sabol: Infrared Spectrum and Thermodynamic Properties of PuF6, Knolls Atomic Power Laboratory Report KAPL-1007 (24. Mai 1954); Abstract.
- ↑ a b c d C. J. Mandleberg, H. K. Rae, R. Hurst, G. Long, D. Davies, K. E. Francis: „Plutonium Hexafluoride“, in: Journal of Inorganic and Nuclear Chemistry, 1956, 2 (5–6), S. 358–367; doi:10.1016/0022-1902(56)80090-0.
- ↑ a b c Alan E. Florin, Irving R. Tannenbaum, Joe F. Lemons: „Preparation and Properties of Plutonium Hexafluoride and Identification of Plutonium(VI) Oxyfluoride“, in: Journal of Inorganic and Nuclear Chemistry, 1956, 2 (5–6), S. 368–379; doi:10.1016/0022-1902(56)80091-2.
- ↑ a b c d e f g h Bernard Weinstock, John G. Malm: „The Properties of Plutonium Hexafluoride“, in: Journal of Inorganic and Nuclear Chemistry, 1956, 2 (5–6), S. 380–394; doi:10.1016/0022-1902(56)80092-4.
- ↑ a b M. J. Steindler: „Laboratory Investigations in Support of Fluid Bed Fluoride Volatility Processes. Part II. The Properties of Plutonium Hexafluoride“, Argonne National Laboratory Report ANL-6753 (1. August 1963); Abstract.
- ↑ M. J. Steindler, D. V. Steidl, R. K. Steunenberg: „The Fluorination of Plutonium Tetrafluoride“, Argonne National Laboratory Report ANL-5875 (1. Juni 1958); Abstract.
- ↑ L. B. Asprey, P. G. Eller, Scott A. Kinkead: „Formation of Actinide Hexafluorides at Ambient Temperatures with Krypton Difluoride“, in: Inorg. Chem., 1986, 25 (5), S. 670–672; doi:10.1021/ic00225a016.
- ↑ J. G. Malm, P. G. Eller, L. B. Asprey: „Low Temperature Synthesis of Plutonium Hexafluoride Using Dioxygen Difluoride“, in: J. Am. Chem. Soc., 1984, 106 (9), S. 2726–2727; doi:10.1021/ja00321a056.
- ↑ P. E. Erilov, V. V. Titov, V. F. Serik, V. B. Sokolov: „Low-Temperature Synthesis of Plutonium Hexafluoride“, in: Atomic Energy, 2002, 92 (1), S. 57–63; doi:10.1023/A:1015106730457.
- ↑ L. E. Trevorrow, T. J. Gerding, M. J. Steindler: „Ultraviolet-Activated Synthesis of Plutonium Hexafluoride at Room Temperature“, in: Inorganic and Nuclear Chemistry Letters, 1969, 5 (10), S. 837–839; doi:10.1016/0020-1650(69)80068-1; Abstract.
- ↑ a b D. M. Gruen, J. G. Malm, B. Weinstock: Magnetic Susceptibility of Plutonium Hexafluoride, in: J. Chem. Phys., 1956, 24 (4), S 905–906; doi:10.1063/1.1742635.
- ↑ a b Masao Kimura, Werner Schomaker, Darwin W. Smith, Bernard Weinstock: „Electron-Diffraction Investigation of the Hexafluorides of Tungsten, Osmium, Iridium, Uranium, Neptunium, and Plutonium“, in: J. Chem. Phys., 1968, 48 (8), S. 4001–4012; doi:10.1063/1.1669727.
- ↑ Martin J. Steindler, William H. Gunther: „The Absorption Spectrum of Plutonium Hexafluoride“, in: Spectrochimica Acta, 1964, 20 (8), S. 1319–1322; doi:10.1016/0371-1951(64)80159-4.
- ↑ R. Kugel, C. Williams, M. Fred, J. G. Malm, W. T. Carnall, J. C. Hindman, W. J. Childs, L. S. Goodman: „Isotope Effects in the Molecular Spectrum of Plutonium Hexafluoride“, in: Journal of Chemical Physics, 1976, 65 (9), S. 3486–3492; doi:10.1063/1.433575.
- ↑ R. T. Walters, R. A. Briesmeister: „Absorption Spectrum of Plutonium Hexafluoride in the 3000–9000 Å Spectral Region“, in: Spectrochimica Acta Part A: Molecular Spectroscopy, 1984, 40 (7), S. 587–589; doi:10.1016/0584-8539(84)80108-7.
- ↑ B. Weinstock, E. E. Weaver, J. G. Malm: „Vapour-Pressures of NpF6 and PuF6; Thermodynamic Calculations with UF6, NpF6 and PuF6“, in: Journal of Inorganic and Nuclear Chemistry, 1959, 11 (2), S. 104–114; doi:10.1016/0022-1902(59)80054-3.
- ↑ K. C. Kim, R. N. Mulford: „Vibrational Properties of Actinide (U, Np, Pu, Am) Hexafluoride Molecules“, in: Journal of Molecular Structure: THEOCHEM, 1990, 207 (3–4), S. 293–299; doi:10.1016/0166-1280(90)85031-H.
- ↑ James V. Beitz, Clayton W. Williams, W. T. Carnall: „Fluorescence Studies of Neptunium and Plutonium Hexafluoride Vapors“, in: Journal of Chemical Physics, 1982, 76, S. 2756–2757; doi:10.1063/1.443223.
- ↑ James V. Beitz, Clayton W. Williams, W. T. Carnall: „Plutonium Hexafluoride Gas Photophysics and Photochemistry“, in: Plutonium Chemistry, ACS Symposium Series 1983, Vol. 216, Chapter 11, S. 155–172; doi:10.1021/bk-1983-0216.ch011; ISBN 978-0-84120772-1, ISBN 978-0-84121031-8.
- ↑ R. W. Kessie: „Plutonium and Uranium Hexafluoride Hydrolysis Kinetics“, in: Ind. Eng. Chem. Proc. Des. Dev., 1967, 6 (1), S. 105–111; doi:10.1021/i260021a018.
- ↑ a b c John G. Malm, Bernard Weinstock, E. Eugene Weaver: „The Preparation and Properties of NpF6; a Comparison with PuF6“, in: J. Phys. Chem., 1958, 62 (12), S. 1506–1508; doi:10.1021/j150570a009.
- ↑ L. E. Trevorrow, W. A. Shinn, R. K. Steunenberg: „The Thermal Decomposition of Plutonium Hexafluoride“, in: J. Phys. Chem., 1961, 65 (3), S. 398–403; doi:10.1021/j100821a003.
- ↑ J. Fischer, L. Trevorrow, W. Shinn: „The Kinetics and Mechanism of the Thermal Decomposition of Plutonium Hexafluoride“, in: J. Phys. Chem., 1961, 65 (10), S. 1843–1846; doi:10.1021/j100827a036.
- ↑ Jack Fischer, L. E. Trevorrow, G. J. Vogel, W. A. Shinn: „Plutonium Hexafluoride Thermal Decomposition Rates“, in: Ind. Eng. Chem. Proc. Des. Dev., 1962, 1 (1), S. 47–51; doi:10.1021/i260001a010.
- ↑ S. Tsujimura, K. Hirano, A. Takahashi, G. Fujisawa: „Thermal Decomposition of Plutonium Hexafluoride“, in: J. Nucl. Sci. and Tech., 1972, 9, S. 534–537; doi:10.3327/jnst.9.534; PDF.
- ↑ R. P. Wagner, W. A. Shinn, J. Fischer, M. J. Steindler: Laboratory Investigations in Support of Fluid-bed Fluoride Volatility Processes, part VII, The Decomposition of Gaseous Plutonium Hexafluoride by Alpha Radiation, Argonne National Laboratory Report ANL-7013 (1. Mai 1965); Abstract.
- ↑ Ned E. Bibler: „α and β Radiolysis of Plutonium Hexafluoride Vapor“, in: J. Phys. Chem., 1979, 83 (17), S. 2179–2186; doi:10.1021/j100480a001.
- ↑ L. R. Morss: PuF6 gas pressure in aged cylinders, personal communication, D. L. Clark, Los Alamos, NM (2005).
- ↑ M. J. Steindler, D. V. Steidl, J. Fischer: „The Decomposition of Plutonium Hexafluoride by Gamma Radiation“, in: Journal of Inorganic and Nuclear Chemistry, 1964, 26 (11), S. 1869–1878; doi:10.1016/0022-1902(64)80011-7.
- ↑ US-Patent 4670239: Photochemical Preparation of Plutonium Pentafluoride; PDF.
- ↑ E. A. Lobikov, V. N. Prusakov, V. F. Serik: „Plutonium Hexafluoride Decomposition under the Action of Laser Radiation“, in: Journal of Fluorine Chemistry, 1992, 58 (2–3), C 54, S. 277; doi:10.1016/S0022-1139(00)80734-4.
- ↑ US-Patent 3708568: Removal of Plutonium from Plutonium Hexafluoride-Uranium Hexafluoride Mixtures; PDF.
- ↑ US-Patent 4172114: Method for Purifying Plutonium Hexafluoride; PDF.
- ↑ W. Scott Moser, James D. Navratil: „Review of Major Plutonium Pyrochemical Technology“, in: Journal of the Less Common Metals, 1984, 100, S. 171–187; doi:10.1016/0022-5088(84)90062-6.
- ↑ Evaluation of the U.S. Department of Energy's Alternatives for the Removal and Disposition of Molten Salt Reactor Experiment Fluoride Salts. Abgerufen am 3. Mai 2010.
- ↑ Yu. V. Drobyshevskii, V. K. Ezhov, E. A. Lobikov, V. N. Prusakov, V. F. Serik, V. B. Sokolov: „Application of Physical Methods for Reducing Plutonium Hexafluoride“, in: Atomic Energy, 2002, 93 (1), S. 578–588; doi:10.1023/A:1020840716387.
- ↑ A. M. Pokidyshev, I. A. Tsarenko, V. F. Serik, V. B. Sokolov: „Reduction of Plutonium Hexafluoride Using Gaseous Reagents“, in: Atomic Energy, 2003, 95 (4), S. 701–708; doi:10.1023/B:ATEN.0000010988.94533.24.
- ↑ T. R. Mills, L. W. Reese: „Separation of Plutonium and Americium by Low-Temperature Fluorination“, in: Journal of Alloys and Compounds, 1994, 213–214, S. 360–362; doi:10.1016/0925-8388(94)90931-8.
Kategorien:- Radioaktiver Stoff
- Plutoniumverbindung
- Fluorverbindung
Wikimedia Foundation.