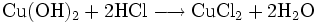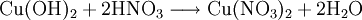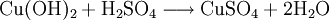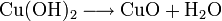- Kupferdihydroxid
-
Strukturformel Keine Strukturformel vorhanden Allgemeines Name Kupfer(II)-hydroxid Andere Namen - Kupferhydroxid
- Kupferdihydroxid
- Blaukupfer
- Kupferoxidhydrat
Summenformel Cu(OH)2 CAS-Nummer 20427-59-2 Kurzbeschreibung geruchloses hellblaues Pulver[1] Eigenschaften Molare Masse 97,56 g·mol–1 Aggregatzustand fest
Dichte 3,368 g·cm–3[1]
Schmelzpunkt 160 °C [2] Zersetzung ab 80 °C zu Wasser und Kupferoxid)[1]
Löslichkeit unlöslich in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22 S: 20/21-22-28-46 MAK 0,1 mg·m–3[1]
LD50 Ratte(oral) 1000 mg/kg[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kupfer(II)-hydroxid ist ein Hydroxid-Salz des Kupfers. Es ist ein blauer Feststoff, der allein oder in Mischung das Farbpigment Bremer Blau (auch Kalkblau genannt) bildet.[3]
Inhaltsverzeichnis
Vorkommen
Natürlich kommt Kupfer(II)-hydroxid als Bestandteil der grünen Patina von Kupfer vor, welches eine Mischung von Kupferhydroxid und Kupfer(II)-carbonat ist.
Gewinnung und Darstellung
Kupferhydroxid kann durch Reaktion von Kupfersalzen mit Alkalilaugen hergestellt werden.[4] Typischerweise wird dazu Kupfersulfat-Pentahydrat in Wasser aufgelöst und unter Kühlung durch Zugabe von Natriumhydroxid zu Kupferhydroxid und Natriumsulfat umgesetzt.
Alternativ kann Kupferhydroxid auch durch die elektrochemische Umsetzung von Kupfer in Wasser hergestellt werden.
Eigenschaften
Kupfer(II)-hydroxid ist unlöslich in kaltem Wasser. In konzentrierten Alkalilaugen ist die Verbindung löslich. Dabei bilden sich Hydroxokomplexe wie das tiefblaue [Cu(OH)4]2-. Die Reaktion mit Mineralsäuren führt zu den entsprechenden Kupfer(II)-salzen.
Beim Erwärmen zerfällt (frisch gefälltes) Kupfer(II)-hydroxid zu Kupfer(II)-oxid und Wasser.
Verwendung
Kupfer(II)-hydroxid wird verwendet als
- Pflanzenschutzmittel (Fungizid im Obst-, Wein-, Hopfen-, Gemüse-, und Bananenanbau)
- zur Herstellung von Pigmenten (z. B. von Peligotblau, welches lichtecht bei künstlichem Licht ist)
- zur Herstellung der unter der Bezeichnung Schweizers Reagens bekannten ammoniakalischen Lösung, die als Reagens und zum Auflösen von Kunstseide dient.
- zur Herstellung von Kupferseide[5]
- zur Herstellung von Beizmitteln, Schiffsbodenfarben, Katalysatoren[1]
Siehe auch
- Fehling-Probe (ohne die Zugabe von Kaliumnatriumtartrat würde Kupferhydroxid ausfallen)
- Kupfer(I)-hydroxid, CuOH
Literatur
- Georg Bauer: Handbuch der präparativen anorganischen Chemie. ISBN 3432260814
- Pradyot Patnaik: Handbook of Inorganic Chemicals. McGraw-Hill, New York 2002 ISBN 0-07-049439-8 (Englisch)
Quellen
- ↑ a b c d e f Eintrag zu CAS-Nr. 20427-59-2 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 9. Dez 2007 (JavaScript erforderlich)
- ↑ a b http://www.sciencelab.com/msds.php?msdsId=9923594
- ↑ http://www.uni-bayreuth.de/departments/ddchemie/umat/komplexfarbe1/komplexfarbe.htm
- ↑ Holleman, Wiberg: Lehrbuch der Anorganischen Chemie, 101. Auflage, Walther de Gruyter Verlag, 1995, S. 1335.
- ↑ http://diefoergs.de/Kap3/3.2.html
Wikimedia Foundation.

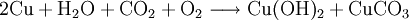
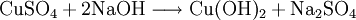
_hydroxide.JPG)