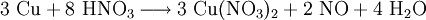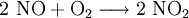- Kupferdinitrat
-
Strukturformel 
Allgemeines Name Kupfer(II)-nitrat Andere Namen Kupferdinitrat
Summenformel Cu(NO3)2 CAS-Nummer - 3251-23-8 wasserfrei
- 10031-43-3 Trihydrat
- 13478-38-1 Hexahydrat
- 19004-19-4 Hemipentahydrat
Kurzbeschreibung kristalliner Feststoff, wasserfrei blaugrün, wasserhaltig tiefblau Eigenschaften Molare Masse 187,55 g/mol Aggregatzustand fest
Schmelzpunkt Siedepunkt Sublimation >140 °C[1]
Löslichkeit gut in Wasser (1378 g/l bei 20 °C[1])
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Brand-
förderndGesundheits-
schädlich(O) (Xn) R- und S-Sätze R: 8-22-36/37/38 S: 17-26-36/37/39 MAK 0,1 mg/m3[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kupfer(II)-nitrat ist das zweiwertige Kupfersalz der Salpetersäure.
Inhaltsverzeichnis
Eigenschaften
Die Hydrate sind tiefblau, die wasserfreie Substanz ist blaugrün. Lösungen des Stoffes weisen mit zunehmender Konzentration eine Farbänderung von Blau nach Dunkelgrün auf. Die Kristalle zerfließen langsam an der Luft.[2]
Außer den genannten Hydraten kann Kupfer(II)-nitrat auch ein Nonahydrat ausbilden, das nur unter −20 °C beständig ist.[2]
Beim Erhitzen der Hydrate erfolgt keine Dehydratisierung, vielmehr entsteht ab ca. 80 °C basisches Kupfer(II)-nitrat, bei Temperaturen über 170 °C Kupfer(II)-oxid.
Der Stoff ist wassergefährdend (WGK 2).[1]
Darstellung und Gewinnung
Das Salz kann im Labor sehr einfach durch Einwirken von halbkonzentrierter Salpetersäure auf metallisches Kupfer gewonnen werden. Bei der Reaktion bildet sich am Kupfer gasförmiges Stickstoffmonoxid, während sich die Lösung mit zunehmender Salzkonzentration analog zum Kupferchlorid von Blau nach Grün verfärbt.
Das entstandene, farblose Stickstoffmonoxid reagiert sofort mit Luftsauerstoff zum rotbraunen Stickstoffdioxid weiter.
Verwendung
Kupfer(II)-nitrat wird verwendet als Weißblechtinte, zum Schwarzfärben von Kupfer und Brünieren von Eisen. Es wird weiterhin zur Herstellung von Kupferoxid, Korrosions- und Holzschutzmitteln, Flotations- und Bohrhilfsmitteln, in der Färberei und Farbstoffindustrie als Oxidationsmittel, sowie zur Nitrierung organischer Verbindungen verwendet.
Quellen
Wikimedia Foundation.

-nitrate-trihydrate-sample.jpg)