- Leuzin
-
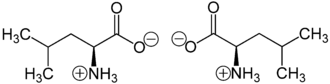
Strukturformel 

L-Leucin (links) bzw. D-Leucin (rechts)Allgemeines Name Leucin Andere Namen - 2-Amino-4-methyl-pentan-1-säure
- Abkürzungen:
- Leu (Dreibuchstabencode)
- L (Einbuchstabencode)
Summenformel C6H13NO2 CAS-Nummer - 61-90-5 (L-Enantiomer)
- 328-38-1 (D-Enantiomer)
PubChem 6106 ATC-Code V06[1]
DrugBank DB00149 Kurzbeschreibung weißer Feststoff Eigenschaften Molare Masse 131,18 g·mol−1 Aggregatzustand fest
Dichte 1,29 g·cm−3[1]
Schmelzpunkt pKs-Wert - pKCOOH: 2,33
- pKNH2: 9,74 [3]
Löslichkeit schlecht in Wasser (24 g·l−1 bei 20 °C)[4], unlöslich in Ethanol und Diethylether [4]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln WGK 1[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Leucin ist eine proteinogene α-Aminosäure. Für höhere Lebewesen ist L-Leucin [Synonym: (S)-Leucin] eine essentielle Aminosäure, die vermutlich für den Energiehaushalt im Muskelgewebe eine zentrale Rolle spielt. Das Spiegelbildisomere (Synonym: Enantiomere) von L-Leucin ist das D-Leucin [Synonym: (R)-Leucin]. Letzteres kommt in Proteinen nicht vor. Leucin kristallisiert in weißen Plättchen, daher leitet sich auch der Name her (gr. λευκός: weiß).
L-Leucin wird von den Codons UUA, UUG, CUU, CUC, CUA und CUG kodiert.
Isoleucin, Norleucin und tert-Leucin sind Konstitutionsisomere.
Inhaltsverzeichnis
Eigenschaften
- Restname: Leucyl-
- essentiell: ja
- Seitenkette: lipophil
- van-der-Waals-Volumen: 124
- Hydrophobizitätsgrad: 3,8
Leucin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxylgruppe an das einsame Elektronenpaar des Stickstoffatoms der Aminogruppe wandert.
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert) der Fall, bei dem das Leucin auch seine geringste Löslichkeit in Wasser hat. Der isoelektrischer Punkt liegt bei 5,98.[5] Racemisches Leucin, welches zum besseren Verständnis der Homochiralität in der Biosphäre zirkular polarisierter Synchrotron-Strahlung ausgesetzt wurde, zeigt einen Enantiomerenüberschuss von 2,6 %.[6]
Vorkommen
Die Aminosäure Leucin ist einer der Hauptbestandteile pflanzlichen und tierischen Proteins. Dabei kann der Anteil von Leucin am Gesamtprotein trotzdem recht verschieden sein. Die folgenden Beispiele für den Leucin-Gehalt beziehen sich auf jeweils 100 g des Lebensmittels:
- Hirse, ganzes Korn: 1123 mg
- Maismehl: 1039 mg
- Weizen-Vollkornmehl: 764 mg
- Reis, ungeschält: 621 mg
- Nüsse: 1742 mg
- grüne Erbsen, roh: 406 mg
- Lachs, roh: 1435 mg
- Steak vom Rind, roh: 1783 mg
- Steak vom Schwein, roh: 1512 mg
- Kuhmilch, fettarm: 321 mg
- Hüttenkäse : 1197 mg
- Hühnerei, roh : 1082 mg
Funktionen
L-Leucin ist wichtig für den Erhalt und Aufbau von Muskelgewebe. Es unterstützt die Proteinsynthese in Muskulatur und Leber, hemmt den Abbau von Muskelprotein und unterstützt Heilungsprozesse. Wie L-Isoleucin dient auch L-Leucin als Energielieferant. Ein Mangel ist entweder durch ungenügende Zufuhr mit der Nahrung oder Unterversorgung mit Vitamin B6 bedingt.
Verwendung
Es ist wirksamer Bestandteil von Infusionslösungen.
Siehe auch
Einzelnachweise
- ↑ a b c Sicherheitsdatenblatt Carl Roth.
- ↑ Daten der Firma Sigma-Aldrich.
- ↑ Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, Hirzel Verlag, Stuttgart, 1991, ISBN 3-7776-0485-2, dort Seite 823.
- ↑ a b Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.1. Georg Thieme Verlag KG, Stuttgart 2008.
- ↑ P. M. Hardy: The Protein Amino Acids in G. C. Barrett (Herausgeber): Chemistry and Biochemistry of the Amino Acids, Chapman and Hall, 1985, ISBN 0-412-23410-6, S. 9.
- ↑ Meierhenrich: Amino acids and the asymmetry of life, Springer-Verlag, 2008, ISBN 978-3-540-76885-2.
Literatur
- Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, 20. Auflage, S. Hirzel Verlag, Stuttgart, 1984, ISBN 3-7776-0406-2.
- Hans-Dieter Jakubke und Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, 1982, ISBN 3-527-25892-2.
- Jesse Philip Greenstein und Milton Winitz: Chemistry of Amino Acids, John Wiley & Sons, 1962, Bände 1 bis 3, ISBN 0-471-32637-2.
- Yoshiharu Izumi, Ichiro Chibata und Tamio Itoh: "Production and Utilization of Amino Acids", Angewandte Chemie International Edition in English 1978, 17, 176–183.
Weblinks
- Nährstoff-Datenbank des Deutschen Ernährungsberatungs- und -informationsnetzes (DEBInet)
Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
Wikimedia Foundation.