- Lochkorrosion
-
Lochfraßkorrosion (auch Lochkorrosion oder Lochfraß) bezeichnet kleinflächige, aber oft tiefe Korrosionen von Metall. Lochkorrosion tritt bei passivierten Metallen auf, die sich in einem chlorid- oder bromidhaltigen Elektrolyten befinden. Aus dem Alltag bekannt ist das Phänomen bei Stahltöpfen, bei denen Lochfraß durch das Salzen von noch nicht kochendem Wasser auftreten kann, da das Salz längere Zeit Kontakt zum heißen Stahlboden hat, wenn es sich nicht sofort löst (was aber bei kochendem Wasser der Fall ist).
Entstehung
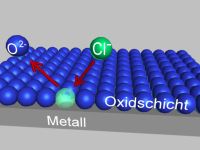
Aus der Oxidschicht des passivierten Metalls wird Sauerstoff durch Chlorid- bzw. Bromidionen verdrängt. Durch Anlagerung von weiteren Chlorid- und Bromidionen entsteht ein Bereich, der nicht mehr durch eine Oxidschicht geschützt ist. Diese Stelle bietet nun einen Angriffspunkt für Korrosion.
Unter günstigen Umständen kann es zu einer sogenannten Repassivierung kommen: Das Chloridion wird wieder durch Sauerstoff verdrängt, die schützende Oxidschicht ist somit wieder repariert.
Andernfalls schreitet die Lochkorrosion fort. Folgende Mechanismen fördern die Lochfraßkorrosion:
- Durch den geringen Lochdurchmesser gelangt wenig Sauerstoff in das Loch, wodurch die Repassivierung behindert wird. Da der Sauerstoffgehalt außerhalb des Lochs wesentlich größer ist als im Loch, bildet sich außerdem ein Konzentrationselement
- Das kleine Loch bildet die Anode, die restliche Oberfläche die Kathode. Da die Korrosionsgeschwindigkeit durch das Flächenverhältnis von Kathode zu Anode bestimmt wird, schreitet die Reaktion mit großer Geschwindigkeit voran.
- Das gelöste Metall im Loch bildet z. B. mit Chloridionen Salze. Durch Hydrolyse entstehen Hydroniumionen, die den Elektrolyt im Loch ansäuern. Durch den abgesenkten pH-Wert erhöht sich das freie Korrosionspotential und damit die Korrosionsgeschwindigkeit.
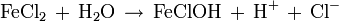
Kritische Bedingungen für das Auftreten von Lochkorrosion
- hohe Temperaturen
- niedriges Elektrodenpotential des Werkstoffs
- niedriger pH-Wert des Elektrolyten
- geringe Sauerstoffkonzentration im Elektrolyt (dadurch keine Repassivierung)
Stähle werden durch Legieren mit Chrom und Molybdän gegen Lochfraßkorrosion beständig gemacht. Lokale Chromverarmungen z. B. bei Chromcarbid-Bildung durch Glühen bei hohen Temperaturen können diesen Schutz jedoch zerstören und führen zu interkristalliner Korrosion. Um den Effekt dieser „Sensibilisierung“ zu vermeiden, wurden die so genannten IF-Stähle entwickelt, die keinerlei freien Kohlenstoff mehr aufweisen und somit keine Chromcarbide bilden können.
Wikimedia Foundation.