- Lyon-Hypothese
-
 Kern einer weiblichen menschlichen Zelle aus Amnionflüssigkeit. Oben: Darstellung beider X-Chromosomen durch Fluoreszenz-in-situ-Hybridisierung. Gezeigt ist ein einzelner optischer Schnitt, der mit einem konfokalen Laserscanningmikroskop erzeugt wurde. Unten: der gleiche Kern mit DAPI-Färbung, aufgenommen mit einer CCD-Kamera. Das Barr-Körperchen ist hier gut zu erkennen (Pfeil) und identifiziert das inaktive X-Chromosom (Xi).
Kern einer weiblichen menschlichen Zelle aus Amnionflüssigkeit. Oben: Darstellung beider X-Chromosomen durch Fluoreszenz-in-situ-Hybridisierung. Gezeigt ist ein einzelner optischer Schnitt, der mit einem konfokalen Laserscanningmikroskop erzeugt wurde. Unten: der gleiche Kern mit DAPI-Färbung, aufgenommen mit einer CCD-Kamera. Das Barr-Körperchen ist hier gut zu erkennen (Pfeil) und identifiziert das inaktive X-Chromosom (Xi).Als X-Inaktivierung oder X-Chromosom-Inaktivierung, früher auch Lyonisierung, wird in der Epigenetik ein Prozess bezeichnet, bei dem ein X-Chromosom ganz oder weitgehend stillgelegt wird, so dass von diesem Chromosom keine Genprodukte mehr erstellt werden. Am bekanntesten ist die X-Inaktivierung bei Säugern. Bei diesen kommen in normalen weiblichen Individuen zwei X-Chromosomen pro Zelle vor, in normalen männlichen Individuen dagegen ein X-Chromosom und ein Y-Chromosom (siehe auch Geschlechtschromosom). Um die höhere Menge an X-chromosomalen Genen auszugleichen, werden während der Embryonalentwicklung in Zellen mit mehr als einem X-Chromosom alle bis auf eines durch Verpackung in Heterochromatin inaktiviert, es entstehen Barr-Körperchen. Dieser Vorgang wurde erstmals 1961 durch die englische Genetikerin Mary Frances Lyon postuliert und dementsprechend als Lyon-Hypothese bezeichnet. Die X-Inaktivierung ist heute detailliert untersucht und dokumentiert, so dass die Bezeichnung als Hypothese nur noch historische Bedeutung hat.
Ein einmal inaktiviertes X-Chromosom bleibt durch epigenetische Regulation fortlaufend inaktiv und wird so von einer Zelle auf alle Tochterzellen weitergegeben. Es handelt sich um eine Regulation der Genexpression, nicht etwa um eine Änderung der DNA-Sequenz. Daher ist die X-Inaktivierung prinzipiell umkehrbar. Tatsächlich wird sie in bestimmten Entwicklungsstadien der Keimbahn aufgehoben. In somatischen Zellen findet eine Aufhebung nicht statt.
Beim Menschen, der Maus und vermutlich allen höheren Säugetieren ist es vom Zufall abhängig, welches der beiden vorhandenen X-Chromosomen während der Embryonalentwicklung in einer Zelle inaktiviert wird und dann in allen Tochterzellen inaktiv bleibt. Dies ist eine mögliche Ursache für phänotypische Unterschiede bei eineiigen Schwestern. Bei den Beuteltieren ist hingegen stets das väterliche X-Chromosom inaktiv. Auf der X-Inaktivierung beruhen bei einigen Tierarten auch Unterschiede in der Farbgestaltung zwischen beiden Geschlechtern.
Auch beim Fadenwurm Caenorhabditis elegans wurde eine X-Inaktivierung beobachtet. Wenn nicht ausdrücklich anders erwähnt beziehen sich die Informationen in diesem Artikel jedoch auf die X-Inakivierung bei Beuteltieren und höheren Säugetieren (Plazentatiere) beziehungsweise auf Untersuchungsergebnisse bei menschlichen und Mauszellen.
Inhaltsverzeichnis
Notwendigkeit der Inaktivierung: Dosiskompensation
- siehe auch: Geschlechtschromosom
Bei Säugetieren wird das Geschlecht durch die Ausstattung an sogenannten Geschlechtschromosomen (Gonosomen) festgelegt. Weibchen besitzen zwei X-Chromosomen, Männchen ein X- und ein Y-Chromosom. Es wird heute davon ausgegangen, dass sich Geschlechtschromosomen während der Evolution aus einem Paar Autosomen entwickelt haben (siehe Y-Chromosom). Das Y-Chromosom hat sich nach dieser Ansicht stetig verkleinert, so dass viele Gene schließlich nur noch auf dem X-Chromosom vorkamen.[1] Dadurch wurde ein verstärktes Ablesen des X-Chromosoms im Männchen erforderlich, um die ursprüngliche Dosis an Genprodukten aufrecht zu erhalten. Um trotz dieser Hochregulation des X-Chromosoms eine im Vergleich zur ursprünglichen Menge erhöhte Dosis an Genprodukten beim Weibchen zu vermeiden, entwickelte sich ein Mechanismus, der eines der beiden weiblichen X-Chromosomen stilllegte, die X-Inaktivierung.[1] Als Folge der X-Inaktivierung bestehen für die meisten Genprodukte von X-chromosomalen Genen keine geschlechtsspezifischen Unterschiede, wie sie ansonsten zu erwarten wären.
Die Inaktivierung des X-Chromosoms ist nicht vollständig, eine Reihe von Genen werden nicht inaktiviert. Dies gilt für Gene der auf X- und Y-Chromosom identischen pseudoautosomalen Regionen. Auch außerhalb der pseudoautosomalen Region kommen einige Gene sowohl auf dem X- wie auf dem Y-Chromosom vor, so dass eine Dosiskompensation nicht erforderlich ist. Das Xist-Gen, das bei der Inaktivierung selbst eine wichtige Rolle spielt (siehe unten), wird dagegen nur auf dem inaktiven X-Chromosom abgelesen (transkribiert).
Arten der Inaktivierung
Männliche Meiose
Eine meiotische Inaktivierung von Geschlechtschromosomen (‚meiotic sex chromosome inactivation‘, MSCI) wurde bei sehr verschiedenen Organismen beobachtet. Neben der Maus, bei der eingehende Untersuchungen durchgeführt wurden, sind hier die Spitzmausbeutelratte Monodelphis domestica, der Schimmelpilz Neurospora crassa und C. elegans zu nennen (siehe unten). Da X- und Y- Chromosomen gleichermaßen betroffen sind handelt es sich also nicht um eine spezifische X-Inakivierung. Diese Inaktivierung geschieht während des Pachytäns, jenem Stadium der Meiose, in dem die homologen Chromosomen gepaart sind. Ungepaarte Chromosomen oder chromosomale Abschnitte werden hier grundsätzlich stillgelegt. Möglicherweise besteht der ursprünglich Nutzen dieses Mechanismus für den Organismus darin, die Meiose anzuhalten, so lange noch ungepaarte Abschnitte vorhanden sind, oder darin, die Genexpression von fremder DNA wie Transposons oder Retroviren zu verhindern.[1]
Bei männlichen Säugern ist eine Paarung von X- und Y-Chromosom in der Meiose nur in den pseudoautosmalen Regionen möglich, die an den Enden der Chromosomen liegen, nicht aber in den Regionen dazwischen. In der Maus werden diese ungepaarten Abschnitte von Proteinen erkannt, die sonst für die Erkennung von DNA-Brüchen zuständig sind. Diese wiederum lagern Markierungen an, die für einen Stopp der Genexpression sorgen. Es entsteht eine heterochromatische, mikroskopisch nachweisbare Struktur, der ‚XY-Body‘. Der inaktivierte Zustand bleibt für den Rest der Spermatogenese erhalten, mit Ausnahme einiger Gene, die für die Spermatogenese selbst benötigt werden. Beuteltiere haben keine pseudoautosomalen Regionen. Eine meiotische Paarung von X- und Y-Chromosom über homologe Sequenzen ist daher nicht möglich. Die beiden inaktivierten Chromosomen kommen erst spät im Pachytän zusammen und bleiben dann ebenfalls für den Rest der Spermatogenese inaktiv. [1]
Väterliches X-Chromosom
Bei Beuteltieren wird immer das väterliche X-Chromosom inaktiviert. Dessen Erkennung wird durch Imprinting gesteuert (englisch: imprinted X-Inactivation): In der weiblichen Keimbahn werden dabei an den Chromosomen andere Markierungen angebracht als in der männlichen Keimbahn, so das im entstehenden Organismus erkannt werden kann, von welchem Elternteil ein bestimmtes Chromosom vererbt wurde. Der genaue Mechanismus der Inaktivierung bei Beuteltieren ist noch unverstanden. Möglicherweise sind die Inaktiverungsmarker, die in der männlichen Keimbahn am X-Chromosom angebracht werden, ausschlaggebend. Auch werden nicht alle Gene auf dem inaktiven X stillgelegt.[1]
Bei Plazentatieren findet eine nicht-zufällige, spezifische Inaktivierung des väterlichen X-Chromosoms während der frühen Embryonalentwicklung statt. Für Mäuse wurde folgender Ablauf beschrieben: Im 2-Zell-Stadium, wenn bei Mäusen die Genexpression erstmals einsetzt, wird auf dem väterlichen X-Chromosom das Xist-Gen abgelesen. Von der XIST-RNA, die dabei entsteht, ist bekannt, dass sie zumindest bei der später stattfindenden zufälligen X-Inaktivierung eine wichtige Rolle spielt. Jetzt verbleibt sie zunächst in der unmittelbaren Nähe des Xist-Gens, während der nächsten Zellteilungen dehnt sich ihr Verbreitungsgebiet aber zunehmend aus, bis Sie schließlich das väterliche X-Chromosom bedeckt. Einher geht eine zunehmende Inaktivierung des Chromosoms. Ab dem Morula-Stadium (kugeliger Zellhaufen) nimmt die Xist-Expression wieder ab, so das im darauffolgenden Blastocysten-Stadium (Embryo schon getrennt von Trophoblast, aus dem die Plazenta hervorgeht) im Embryo selbst beide X-Chromosomen aktiv sind. Im extraembryonalen Gewebe bleibt jedoch durchgehend das väterliche X-Chromosom inaktiv. Diese Inaktivierung wird wiederum von Xist reguliert.[1]
Beuteltiere haben kein Xist-Gen. Da sich die nicht-zufällige Inaktivierung des väterlichen X bei Beuteltieren und bei Plazentatiere findet, geht man davon aus, dass dies der ursprüngliche Prozess ist, aus dem sich die zufällige Auswahl bei höheren Säugetieren entwickelt hat.[1]
Zufällige Auswahl
 Das schwarz-rote Schildpattmuster bei manchen weiblichen Katzen wird durch X-Inaktivierung verursacht: Das verantwortliche Gen liegt auf dem X-Chromosom und kommt in verschiedenen Ausprägungen (Allelen) vor. Je nachdem welches X-Chromosom in den entsprechenden Zellen aktiv ist, tritt entweder die rote oder die schwarze Fellfarbe auf. Da die zufällige Auswahl des inaktivierten X-Chromosoms in der frühen Embryonalentwicklung erfolgt und dann an alle Tochterzellen weitergegeben wird, entstehen Fellflecken mit gleichartiger Färbung.
Das schwarz-rote Schildpattmuster bei manchen weiblichen Katzen wird durch X-Inaktivierung verursacht: Das verantwortliche Gen liegt auf dem X-Chromosom und kommt in verschiedenen Ausprägungen (Allelen) vor. Je nachdem welches X-Chromosom in den entsprechenden Zellen aktiv ist, tritt entweder die rote oder die schwarze Fellfarbe auf. Da die zufällige Auswahl des inaktivierten X-Chromosoms in der frühen Embryonalentwicklung erfolgt und dann an alle Tochterzellen weitergegeben wird, entstehen Fellflecken mit gleichartiger Färbung.Bei Menschen und den höheren Säugetieren (Plazentatiere) wird die bleibende Auswahl des zu inaktivierenden X-Chromosoms in den Zellen des Embryos zufällig und in jeder Zelle eigenständig getroffen. Diese Art der Auswahl wird als Vorteil angesehen, da so im weiblichen Organismus bei einer schädlichen Mutation auf einem der X-Chromosomen diese nur in etwa der Hälfte der Zellen zum Tragen kommt und die gesunden Zellen dies in vielen Fällen weitgehend ausgleichen können. [1] Der zugrunde liegende Mechanismus wird im folgenden Abschnitt dargestellt.
Ablauf der Inaktivierung bei höheren Säugetieren
Die im Folgenden dargestellten Vorgänge sind beim Menschen und bei der Maus gut untersucht. Es wird angenommen, dass Sie bei anderen Säugetieren vergleichbar ablaufen.
XIST-RNA
In der Embryonalentwicklung findet die X-Inaktivierung etwa zum Zeitpunkt der Differenzierung der pluripotenten Zellen zu verschiedenen Zellschichten statt, also während des Blastozystenstadiums. Dabei spielt das Xist-Gen eine wichtige Rolle.
Die X-Inaktivierung erfolgt durch das Binden einer speziellen Ribonukleinsäure (RNA) an das betreffende X-Chromosom. Diese RNA wird als X inactive specific transcript beziehungsweise kurz als Xist-RNA bezeichnet, das entsprechende Gen befindet sich in einem als X Inactivation Center (XIC) bezeichneten Abschnitt des X-Chromosoms. Es wird vermutet, dass zum Xist-Gen kein korrespondierendes Protein existiert, sondern dass dieses Gen ausschließlich über die entsprechende RNA wirkt. Es unterliegt also der Transkription von DNA zu RNA, nicht jedoch der Translation von RNA zum Protein (siehe Non-coding RNA).
Durch die Bindung der Xist-RNA an das zu inaktivierende X-Chromosom werden viele der Gene auf diesem Chromosom inaktiviert. Ausnahmen sind das Xist-Gen selber sowie rund ein Viertel der restlichen Gene, insbesondere im Bereich der als pseudoautosomale Regionen bezeichneten Abschnitten an beiden Enden des X-Chromosoms, Bereichen mit entsprechenden homologen Abschnitten auf dem Y-Chromosom.
Vor der X-Inaktivierung werden von beiden Chromosomen geringe Mengen an Xist-RNA gebildet. Auf dem später aktiven X-Chromosom (Xa) erfolgt dann keine Expression des Xist-Gens mehr, während es auf dem inaktiviertem X-Chromosom (Xi) zu den wenigen aktiven Genen zählt.
Das Xist-Gen auf dem X-Chromosom der Mutter liegt in der Eizelle zunächst methyliert, d.h. inaktiv vor, das X-Chromosom ist dementsprechend aktiv. Kommt mit dem Spermium ein Y-Chromosom hinzu, so bleibt das Xist-Gen methyliert. Kommt jedoch ein weiteres X-Chromosom hinzu, so liegt bei ihm das Xist-Gen nicht methyliert vor (das Xist-Gen wird nur bei der Spermatogenese exprimiert). Es entsteht die Xist RNA und auch das zweite X-Chromosom wird inaktiviert. Dieser Zustand ist jedoch nicht stabil, da für die Aufrechterhaltung das eed-Protein benötigt wird und dies ebenfalls auf dem X-Chromosom kodiert vorliegt. Dadurch werden im Morula-Stadium beide X-Chromosomen und somit das Xist-Gen wieder aktiv. Diesmal wird jedoch nur ein X-Chromosom inaktiviert, wobei entweder das väterliche oder das mütterliche X-Chromosom ausgeschaltet wird. Da dies erst im mehrtägigen Embryo (bei der Maus nach dem siebten Tag, bei Menschen nach 16 Tagen) erfolgt, sind Säugerweibchen sogenannte genetische X-Mosaike. Dies lässt sich zum Beispiel an der Fellfarbe von Katzen gut erkennen (siehe Abbildung).
Heterochromatinisierung und Barr-Körperchen
- siehe auch: Geschlechts-Chromatin
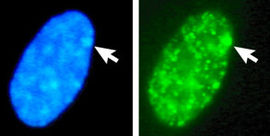 Der Zellkern eines menschlichen, weiblichen Fibroblasten wurde mit dem blau fluoreszierenden DNA-Farbstoff DAPI angefärbt, um das Barr-Körperchen, also das inaktive X-Chromosom darzustellen (Pfeil). Außerdem wurde im gleichen Kern eine Sonderform eines Histons (macroH2A) mit Antikörpern nachgewiesen, die an einen grünen Fluoreszenz-Farbstoff gekoppelt waren. Diese Histon-Sonderform ist im Barr-Körperchen angereichert.
Der Zellkern eines menschlichen, weiblichen Fibroblasten wurde mit dem blau fluoreszierenden DNA-Farbstoff DAPI angefärbt, um das Barr-Körperchen, also das inaktive X-Chromosom darzustellen (Pfeil). Außerdem wurde im gleichen Kern eine Sonderform eines Histons (macroH2A) mit Antikörpern nachgewiesen, die an einen grünen Fluoreszenz-Farbstoff gekoppelt waren. Diese Histon-Sonderform ist im Barr-Körperchen angereichert.Das Binden der Xist RNA löst zusammen mit weiteren Faktoren eine Hypoacetylierung der Histone aus, die mit speziellen inaktivierenden Methylierungsmustern der Histone einhergeht. Schließlich wird das normalerweise vorhandene Histon H2A durch die Variante macroH2A ersetzt (siehe Abbildung). Dadurch kommt es zur DNA-Methylierung und damit zur Inaktivierung der Promotor. Dies geht einher mit der Verdichtung des Chromatins in Form von Heterochromatin, das spät repliziert und meist in peripheren Bereichen des Zellkerns zu finden ist. Entsprechend inaktivierte und verdichtete X-Chromosomen werden als Barr-Körper (englisch Barr bodies) oder Geschlechts-Chromatin bezeichnet, die Bildung von Barr-Körpern als Lyonization.
Mit der Inaktivierung des X-Chromosoms kommt es zu folgenden molekularen Veränderungen:
- viele Promotor (insbesondere GC-Blöcke) werden methyliert und somit die Gene ausgeschaltet
- die Histone H3 werden methyliert und die Histone H4 deacetyliert. Dadurch wird die DNA stärker an die Histone gebunden, was das Ablesen erschwert. Das inaktivierte X-Chromosom wird somit zum optisch dichteren Heterochromatin und wird als Barr-Körper bezeichnet.
Die Heterochromatinisierung geschieht beim Menschen nicht vollständig und gleichartig, weswegen bei heterozygot vorliegenden Allelen von X-chromosomal-rezessiv vererbten Krankheiten diese nicht ausbrechen müssen. Dies erklärt, warum Männer häufiger an solchen Krankheiten, wie der Bluterkrankheit, erkranken. Ihnen fehlt das zweite X zum eventuellen Ausgleichen.
Der mikroskopische Nachweis von Barr-Körpern dient zur Bestimmung des genetischen Geschlechts einer Person, beispielsweise in der Sportmedizin.
Abweichende Anzahl von X-Chromosomen und Barr-Körperchen
Das Vorhandensein von zusätzlichen X-Chromosomen und damit Abweichungen vom Karyotyp XX bei Frauen oder XY bei Männern führt aufgrund der X-Inaktivierung, im Gegensatz zu den oft schwerwiegenden Folgen von zusätzlich vorhandenen Autosomen, in der Regel zu milden und gut behandelbaren Symptomen oder sogar zu einem symptomlosen Verlauf. Dies gilt beispielsweise für das Triplo-X-Syndrom (47,XXX) bei Frauen oder das Klinefelter-Syndrom (47,XXY) bei Männern.
Entdeckungsgeschichte
Barr-Körperchen wurden erstmals 1949 von Murray Llewellyn Barr und Ewart George Bertram für Neuronen weiblicher Katzen beschrieben[2]. Sie fanden ein Chromatin-Körperchen an der Innenseite der Kernmembran, das sie als Sex Chromatin (Geschlechts-Chromatin) bezeichneten. Sie konnten zeigen, dass durch den Nachweis eine Bestimmung des Geschlechts möglich war.
Die englische Genetikerin Mary Frances Lyon postulierte 1961, dass eines der beiden in einer weiblichen Zelle vorhandenen X-Chromosomen inaktiv sei, dass die Inaktivierung früh in der Embryonalentwicklung stattfinden würde und die Auswahl des betreffenden X-Chromosoms zufällig sei[3]. Diese Hypothese beruhte auf Beobachtungen bei der Kreuzung verschiedener Mäusestämme und sich daraus ergebenden Unterschieden bei den Nachkommen in der Fellfärbung und Haarform. Mary Frances Lyon erkannte darüber hinaus das von Barr und Bertram beschriebene Sex Chromatin als inaktivierte X-Chromosomen und prägte den heute verwendeten Begriff Barr-Body, auf Deutsch meist als Barr-Körperchen übersetzt, seltener als Barr-Körper.
Der Durchbruch zum Verständnis des Mechanismus der X-Inaktivierung kam 1991 mit der Beschreibung der Xist-Gene des Menschen und der Maus[4]. Ein Jahr später wurden in mehreren weiteren Arbeiten die RNA-Transkripte der beiden Gene charakterisiert und die Expression sowie deren Zusammenhang mit der X-Inaktivierung dokumentiert [5].
1993 konnte erstmals ein Zusammenhang zwischen Störungen der Xist-Expression und einem seltenen, auf dem Vorhandensein von X-Ringchromosomen beruhenden, Krankheitsbild gezeigt werden. Ein Jahr später wurde erstmals das Xist-Gen für diagnostische Zwecke zum Nachweis des Klinefelter-Syndroms genutzt. In den folgenden Jahren wurden die der X-Inaktivierung zugrundeliegenden Mechanismen durch weitere Arbeiten detailliert aufgeklärt.
X-Inaktivierung bei C. elegans
Beim Fadenwurm Caenorhabditis elegans wurde ebenfalls eine Inaktivierung von X-Chromosomen beschrieben. Diese liegt allerdings nicht in somatischen Zellen vor, sondern in einem Stadium der Keimbahn. Bei C. elegans gibt es zwei Geschlechter: Hermaphroditen mit zwei X-Chromosomen und Männchen mit nur einem X-Chromosom (X0, siehe auch Geschlechtschromosomen). Die Genexpression auf dem X-Chromosom wird während der Meiose in beiden Geschlechtern herunterreguliert, im Weibchen auf beiden X-Chromosomen. Auch hier gehen bestimmte Modifikationen der Histone mit der Inaktivierung einher. Entsprechende Unterschiede in den Histonmodifikationen wurden auch in meiotischen Zellen anderer Nematodenarten gemacht, sowohl in hermaphroditischen Arten als auch in Arten mit Männchen und Weibchen.[6]
Literatur
- J.C. Chow, Z. Yen, S.M. Ziesche, C.J. Brown: Silencing of the mammalian X chromosome. In: Annual Review of Genomics and Human Genetics. 6/2005. Annual Reviews, S. 69–92, ISSN 1527-8204
Einzelnachweise
- ↑ a b c d e f g h Payer B, Lee JT: X Chromosome Dosage Compensation: How Mammals Keep the Balance. In: Annual review of genetics. August 2008. doi:10.1146/annurev.genet.42.110807.091711. PMID 18729722
- ↑ M.L. Barr and E.G. Bertram: A morphological distinction between neurones of the male and female and the behaviour of the nuclear satellite during accelerated nucleoprotein synthesis. In: Nature. 163/1949. Nature Publishing Group, S. 676–677, ISSN 0028-0836
- ↑ M.F. Lyon: Gene action in the X-chromosome of the mouse (Mus musculus L.). In: Nature. 190/1961. Nature Publishing Group, S. 372–373, ISSN 0028-0836
- ↑ C.J. Brown, A. Ballabio, J.L. Rupert, R.G. Lafreniere, M. Grompe, R. Tonlorenzi, H.F. Willard: A gene from the region of the human X inactivation centre is expressed exclusively from the inactive X chromosome. In: Nature. 349/1991. Nature Publishing Group, S. 38–44, PMID 1985261.
- ↑ G. Borsani, R. Tonlorenzi, M.-C. Simmler, L. Dandolo, D. Arnaud, V. Capra, M. Grompe, A. Piizzuti, D. Muzny, C. Lawrence, H.F. Willard, P. Avner, A. Ballabio: Characterization of a murine gene expressed from the inactive X chromosome. In: Nature. 351/1991. Nature Publishing Group, S. 325–332, ISSN 0028-0836
- ↑ William G. Kelly, Christine E. Schaner, Abby F. Dernburg, Min-Ho Lee, Stuart K. Kim, Anne M. Villeneuve and Valerie Reinke: X-chromosome silencing in the germline of C. elegans. Development. 2002 Jan;129(2):479-92. PMID 11807039.
Weblinks
- Entwicklungsbiologie - X-Chromosom Inaktivierung Animation zum Mechanismus (deutsch)
- The Centre for Genetics Education - Factsheet X Chromosome Inactivation (englisch)
Wikimedia Foundation.
