- Maleat
-
Strukturformel 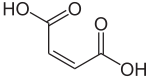
Allgemeines Name Maleinsäure Andere Namen - cis-Butendisäure
- cis-Ethylendicarbonsäure
- Toxilsäure
- (Z)-Butendisäure
Summenformel C4H4O4 CAS-Nummer 110-16-7 PubChem 444266 Kurzbeschreibung weißer Feststoff Eigenschaften Molare Masse 116,07 g·mol−1 Aggregatzustand fest
Dichte 1,59 g·cm−3[1]
Schmelzpunkt Siedepunkt 160 °C[1]
Dampfdruck 30 hPa (20 °C)
pKs-Wert 6,5 [2]
Löslichkeit - gut in Wasser: 788 g·l−1 (25 °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-36/37/38-43 S: (2)-24-26-28-37-46 WGK 1 (schwach wassergefährdend)[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Maleinsäure ist der Trivialname für cis-Butendisäure (auch cis-Ethylendicarbonsäure oder Toxilsäure genannt), einer Dicarbonsäure. Ihre Salze heißen Male(in)ate. Die isomere trans-Form heißt Fumarsäure.
Inhaltsverzeichnis
Eigenschaften
Maleinsäure hat einen Schmelzpunkt von 139 bis 140 °C und bildet bei Raumtemperatur farblose Kristalle. Sie ist in Wasser gut löslich und reagiert darin stark sauer: die zweiprotonige Säure besitzt einen pKs1 von 1,9 und einen pKs2 von 6,5.[2] Bei längerem Erhitzen auf 150 °C sowie bei UV-Bestrahlung isomerisiert die Maleinsäure zur stabileren Fumarsäure. Beim Erhitzen geht sie unter Wasserabspaltung in Maleinsäureanhydrid über. Das Anhydrid bildet beim Auflösen in Wasser dann wieder Maleinsäure.
Herstellung
Maleinsäure wird großtechnisch aus Maleinsäureanhydrid hergestellt; das Anhydrid wiederum wird durch katalytische Oxidation von Benzol oder Butan synthetisiert.
Verwendung
Maleinsäure wird zur Herstellung von Polymeren, Kunstharzen und Maleinsäureestern, zur Veredelung und beim Färben von Baumwolle sowie als Inhaltsstoff von Entkalkungsmitteln eingesetzt. In der Medizin dienen Lösungen der Maleate von Antihistaminen als injizierbare Medikamente für den akuten Einsatz. In der präparativen Chemie wird Maleinsäure häufig als Agens für Diels-Alder-Reaktion benutzt.
Historisches
1874 wurde die räumliche Struktur aus dem chemischen Verhalten – der Anhydridbildung – abgeleitet.
Verwechslungsgefahr
Maleat darf nicht mit dem Säureanion der Äpfelsäure, dem Malat-Ion, oder dem Anion der Malonsäure, dem Malonat verwechselt werden.
Quellen
- ↑ a b c d e Eintrag zu CAS-Nr. 110-16-7 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 05.06.2007 (JavaScript erforderlich)
- ↑ a b A. Reichert: Potentiometrische Titrationen in Theorie und Praxis
- ↑ Eintrag zu CAS-Nr. 110-16-7 im European chemical Substances Information System ESIS
Weblinks
Wikimedia Foundation.
