- Methyl-tert-butylether
-
Strukturformel 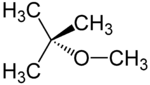
Allgemeines Name Methyl-tert-butylether Andere Namen - tert-Butylmethylether (tBME)
- Methyl-tertiär-butylether (MTBE)
- 2-Methoxy-2-methylpropan
- Plus-minus-ether
Summenformel C5H12O CAS-Nummer 1634-04-4 PubChem 15413 Kurzbeschreibung farblose, flüchtige Flüssigkeit Eigenschaften Molare Masse 88,15 g·mol−1 Aggregatzustand flüssig
Dichte Schmelzpunkt Siedepunkt 55 °C [1]
Dampfdruck Löslichkeit schlecht in Wasser (42 g·l−1 bei 20 °C) [1], gut in den meisten organischen Lösungsmitteln
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Leicht-
entzündlichReizend (F) (Xi) R- und S-Sätze R: 11-38 S: (2)-9-16-24 MAK 180 mg·m–3, 50 ml·m−3 [1]
WGK 1 [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. MTBE, nach IUPAC eigentlich korrekt tert-Butylmethylether, ist ein aliphatischer Ether, der zum einen wegen seiner Verwendung als Zusatzstoff in Ottokraftstoffen sowie zum anderen als Lösungsmittel in der organischen Chemie eine gewisse großtechnische Bedeutung erlangt hat.
Inhaltsverzeichnis
Physikalische Eigenschaften
MTBE ist eine farblose, typisch etherartig riechende Flüssigkeit. Die Verbindung siedet unter Normaldruck bei 55 °C. Der Schmelzpunkt liegt bei −109 °C. Die Mischbarkeit mit Wasser ist eher begrenzt. In Wasser lösen sich bei Raumtemperatur maximal 4,8 g pro 100 g.[3] Umgekehrt lösen sich in MTBE maximal 1,4 g Wasser pro 100 g.[3] Das Azeotrop mit Wasser siedet bei Normaldruck bei 52,9 °C mit einer Azeotropzusammensetzung von 96,5 Ma% MTBE und 3,5 Ma% Wasser.[3]
Thermodynamische Eigenschaften
Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in kPa, T in K) mit A = 6,34991, B = 1312,52 und C = −26,03 im Temperaturbereich von 315 K bis 365 K.[4]
Die wichtigsten thermodynamischen Eigenschaften sind in der folgenden Tabelle aufgelistet:
Eigenschaft Typ Wert [Einheit] Standardbildungsenthalpie ΔfH0liquid
ΔfH0gas−315,4 kJ·mol−1[5]
−285,0 kJ·mol−1.[5]Standardentropie S0liquid
S0g265,3 J·mol−1·K−1[6]
als Flüssigkeit
357,8 J·mol−1·K−1[6]
als GasVerbrennungsenthalpie ΔcH0liquid −3368,97 kJ·mol−1[7] Wärmekapazität cp 187,5 J·mol−1·K−1 (25°C)[6]
als FlüssigkeitSchmelzenthalpie ΔfH0 7,6 kJ·mol−1 [8]
beim SchmelzpunktSchmelzentropie ΔfS0 46,18 kJ·mol−1 [8]
beim SchmelzpunktVerdampfungsenthalpie ΔVH0 27,94 kJ·mol−1.[9]
beim NormaldrucksiedepunktKritische Temperatur TC 223,25 °C[10] Kritischer Druck PC 33.97 bar[10] Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=Aexp(−βTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 46,23 kJ/mol, β = 0,2893 und Tc = 497,1 K im Temperaturbereich zwischen 298 K und 343 K beschreiben. [9]
Sicherheitstechnische Kenngrößen
tert-Butylmethylether bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei −28 °C. Der Explosionsbereich liegt zwischen 1,6 Vol% (58 g/m3) als untere Explosionsgrenze (UEG) und 8,4 Vol% (310 g/m3) als obere Explosionsgrenze (OEG).[3] Eine Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von −33 °C sowie einen oberen Explosionspunkt von −5 °C. Die Grenzspaltweite wurde mit 1 mm bestimmt.[1] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[1] Die Zündtemperatur beträgt 460 °C. [11] Der Stoff fällt somit in die Temperaturklasse T1. Die elektrische Leitfähigkeit ist mit 3,0·10-11 S·m-1 eher gering.
Entsprechend den Gefahrgutvorschriften ist MTBE der Klasse 3 (Entzündbare flüssige Stoffe) mit der Verpackungsgruppe II (mittlere Gefährlichkeit) zugeordnet (Gefahrzettel: 3).[1]
Synthese
MTBE wird großtechnisch säurekatalytisiert aus Isobuten und Methanol hergestellt:
Verwendung
MTBE Kurzbeschreibung Klopfschutzmittel für Ottokraftstoffe Eigenschaften Aggregatzustand flüssig Oktanzahl Flammpunkt −28 °C
Zündtemperatur 460 °C Explosionsgrenze 1,6–8,4 Vol.-% Temperaturklasse T1 Sicherheitshinweise UN-Nummer 2398 [1] Gefahrnummer 33 [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. tert-Butylmethylether wird hauptsächlich als Klopfschutzmittel in Ottokraftstoffen zugesetzt. Es erhöht die Oktanzahl und führt dabei zu einer Verringerung der Klopfneigung des Ottomotors. Es ersetzt Tetraethylblei in unverbleiten Kraftstoffen.
Man findet es auch in so genannten Startersprays, die man bei Startschwierigkeiten in den Ansaugtrakt des Motors spritzen kann.
MTBE findet in der organischen Chemie zunehmend Verwendung als Lösungsmittel sowie Extraktionsmittel. Es ersetzt dabei Ether wie Diethylether oder Tetrahydrofuran, da MTBE eine sehr geringe bis keine Neigung zur Bildung von Peroxiden besitzt.[3] Dies liegt daran, dass am quartären Kohlenstoffatom kein Peroxid gebildet werden kann (da es kein Wasserstoffatom trägt) und eine Peroxidbildung an der Methylgruppe mechanistisch über ein sehr instabiles, primäres Radikal verlaufen müsste.
Weitere Informationen
Diskutiert wird die Umweltverträglichkeit von MTBE besonders im Hinblick auf das Grundwasser. In den USA kam es aufgrund von Tankleckagen zu Verunreinigungen des Trinkwassers. Die Grundwassergefährdung durch Kraftstofflagerung an Tankstellen wird z. B. in Deutschland als untergeordnet betrachtet, da hier an den Tankstellen zumeist doppelwandige Erdtanks verwendet werden. MTBE kann aufgrund des intensiven Geruchs schon in geringen Spuren wahrgenommen werden. Zur Zeit wird in Deutschland vermehrt ETBE (aus Bioethanol und Isobuten) eingesetzt, um die erforderlichen Bio-Beimischungsquoten erfüllen zu können (siehe auch Bioethanol).
Sicherheitshinweise
Wegen der leichten Entzündbarkeit muss mit tert-Butylmethylether stets unter einem gut ziehenden Abzug gearbeitet werden. Die Haut muss gegen Spritzer durch Tragen von Kittel und geeigneten Schutzhandschuhen geschützt werden. Beim Abfüllen größerer Mengen ist es ratsam, Maßnahmen gegen elektrostatische Aufladung zu treffen (Verwendung von Blechkannen und -trichtern, die geerdet werden).
- Bei Einatmen: betroffene Person sofort an die frische Luft bringen. Die Dämpfe können Kopfschmerzen und Benommenheit bis hin zur Ohnmacht hervorrufen.
- Bei Hautkontakt: mit viel Wasser und Seife abwaschen. Intensiver Hautkontakt kann zu denselben Symptomen wie das Einatmen führen.
- Bei Augenkontakt: mindestens 15 Minuten lang intensiv mit Wasser ausspülen (Augendusche).
- Bei Verschlucken: Mund mit viel Wasser ausspülen. Arzt hinzuziehen.
Literatur
- Volker Linnemann (2003): Umweltverhalten von MTBE nach Grundwasserkontamination. Schriften des Forschungszentrums Jülich, Reihe Umwelt/Environment Band/Volume 40, ISSN 1433-5530, ISBN 3-89336-339-4.
Weblinks
- Methyl-tert-Butylether (MTBE) in der aquatischen Umwelt
- Betriebsanweisung für tert-Butylmethylether der Universität Würzburg
Einzelnachweise
- ↑ a b c d e f g h i j k l Eintrag zu Methyl-tert-butylether in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 14.10.2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 1634-04-4 im European chemical Substances Information System ESIS
- ↑ a b c d e K. Watanabe, N. Yamagiwa, Y. Torisawa, Cyclopentyl Methyl Ether as a New and Alternative Process Solvent, Org. Proc. Res. Dev. 11 (2007) 251-258.Abstract
- ↑ A. Aucejo, S. Loras, R. Munoz, Isobaric Vapor-Liquid Equilibrium in the Systems 2-Methylpentane + Methyl 1,1-Dimethylethyl Ether, + Ethyl 1,1-Dimethylethyl Ether, and + Methyl 1,1-Dimethylpropyl Ether, J. Chem. Eng. Data 43 (1998) 973–977. Abstract
- ↑ a b Arntz, H.; Gottlieb, K., High-pressure heat-flow calorimeter determination of the enthalpy of reaction for the synthesis of methyl t-butyl ether from methanol and 2-methylpropene, J. Chem. Thermodyn. 17 (1985) 967-972. Abstract
- ↑ a b c Andon, R.J.L.; Martin, J.F., Thermodynamic properties of organic oxygen compounds. 40. Heat capacity and entropy of six ethers, J. Chem. Thermodynam., 7 (1975) 593-606. Abstract
- ↑ Fenwick, J.O.; Harrop, D.; Head, A.J., Thermodynamic properties of organic oxygen compounds. 41. Enthalpies of formation of eight ethers, J. Chem. Thermodyn.,7 (1975) 943-954. Abstract
- ↑ a b Martin, J.F.; Andon, R.J.L., Thermodynamic properties of organic oxygen compounds. Part LII. Molar heat capacity of ethanoic, propanoic, and butanoic acids, J. Chem. Thermodynam. 14 (1982) 679-688. Abstract
- ↑ a b Majer, V.; Svoboda, V., Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation, Blackwell Scientific Publications, Oxford, 1985, 300.
- ↑ a b Daubert, T.E.; Jalowka, J.W.; Goren, V., Vapor pressure of 22 pure industrial chemicals, AIChE Symp. Ser., 1987, 83, 256, 128-156.
- ↑ E. Brandes, W. Möller: Sicherheitstechnische Kenndaten - Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- ↑ a b Oktanzahlen
Wikimedia Foundation.

.png)