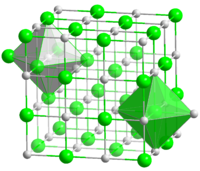
- Natriumchloridstruktur
-
Die für viele Salze typische kubisch-flächenzentrierte Kristallstruktur von Natriumchlorid (Kochsalz) ist Prototyp für die Natriumchlorid-Struktur bzw. den Natriumchloridtyp. Beispiele für Vertreter dieses Strukturtyps sind neben Natriumchlorid selbst Lithiumchlorid (LiCl) und Kaliumchlorid (KCl), aber auch die meisten Erdalkalioxide (z. B. MgO). Ausnahmen, die nicht dem Natriumchloridtyp entsprechen, sind unter anderem Caesiumhalogenide (bis auf Caesiumfluorid) und Berylliumoxid (BeO).
Nimmt man die drei Raumachsen eines Würfels, der der Elementarzelle entspricht, so sind jeweils Natrium- und Chloridionen abwechselnd entlang der x-, y- und z-Achse angeordnet. Jedes Natriumion ist damit oktaedrisch von sechs Chloridionen und umgekehrt jedes Chloridion oktaedrisch von sechs Natriumionen in Form eines Oktaeders umgeben, wodurch diese ein kubisches Raumgitter ausbilden.
Allgemein wird eine Kristallstruktur eindeutig durch ein Punktgitter und eine Basis beschrieben. Hier bildet ein kubisch-flächenzentriertes Gitter (fcc) das Punktgitter mit den kanonischen Einheitsvektoren (
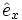 ,
, 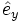 ,
, 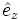 ) als Gittervektoren und a als Gitterparameter. Jeder Gitterpunkt ist mit folgender Basis besetzt:
) als Gittervektoren und a als Gitterparameter. Jeder Gitterpunkt ist mit folgender Basis besetzt:- Na+ bei
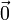 , also auf den Gitterpunkten des fcc-Gitters
, also auf den Gitterpunkten des fcc-Gitters - Cl- bei
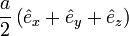 , also im Zentrum der fcc-Einheitszelle mit Kantenlänge a
, also im Zentrum der fcc-Einheitszelle mit Kantenlänge a
Bei anderen Stoffen unterscheidet sich lediglich die Art der Ionen auf den entsprechenden Gitterplätzen, wobei dabei auch unterschiedliche Ionenradien auftreten. Das Verhältnis dieser Ionenradien ist dabei ein wichtiges Kriterium zur Herausbildung eines Natriumchloridtyps. Man kann die Natriumchlorid-Struktur auch als kubisch-flächenzentrierte Packung von Kugeln ansehen (engl. cubic close packed (ccp)). Diese Packung ist mit einer kubisch-dichtesten Packung identisch. Die Schichtfolge in der kubisch-dichtesten Packung ist ABCABC, wie man sehen kann, wenn man Kugeln trigonal übereinander stapelt.
Die Gitterkonstante der Natriumchlorid-Elementarzelle beträgt bei Zimmertemperatur ungefähr 0,564nm (5,64Å).
Literatur
- Holleman, Wiberg: Lehrbuch der anorganischen Chemie. 100. Auflage, Walter de Gruyter, Berlin, New York 1985
- Na+ bei
Wikimedia Foundation.