- Nitrierung
-
Die Nitrierung ist in der Chemie das Einführen einer Nitrogruppe (NO2) in ein organisches Molekül. Synonym steht dieser Begriff meist für die Nitrierung aromatischer Verbindungen, welche als elektrophile aromatische Substitution charakterisiert werden kann. Da in den nitrierten organischen Verbindungen Kohlenstoffatome durch Stickstoffatome von Sauerstoffatomen getrennt sind, kann es passieren, dass das Stickstoffatom die Bindung verlässt und das Kohlenstoffatom mit dem Sauerstoffatom heftig reagiert. Daher sind einige nitrierte organischen Verbindungen als Sprengstoffe zu gebrauchen. Bekannte Beispiele sind Trinitrotoluol (Abkz.: TNT) und Pikrinsäure.
Reaktionsmechanismus
Die Nitrierung eines Aromaten ist das klassische Beispiel für die elektrophile aromatische Substitution. Als elektrophiles Teilchen fungiert das Nitroniumion (+NO2). Dieses entsteht durch Dehydratisierung (Wasserabspaltung) aus der protonierten Salpetersäure und ist in stark saurem Medium recht stabil. Die Dehydratisierung der Salpetersäure geschieht durch das Zusetzen von konzentrierter Schwefelsäure. Das dabei entstehende Gemisch an konzentrierter Schwefel- und Salpetersäure wird als "Nitriersäure" bezeichnet. Die schwächere Salpetersäure wird durch die Schwefelsäure protoniert, wodurch Wasser als Fluchtgruppe aus der Salpetersäure abgespalten wird und das Nitroniumion (+NO2) entsteht. Das freiwerdende Wasser wird wiederum von der Schwefelsäure protoniert und es entsteht das Oxoniumion.
Letztendlich entstehen aus der mehrstufigen Protonierungsreaktion vier Spezies: das Nitroniumion, das Oxoniumion H3O+ und zwei Hydrogensulfat-Anionen HSO4–. Experimentell bestätigt wird das Auftreten dieser Produkte durch Analyse kolligativer Effekte: die Gefrierpunktserniedrigung der Nitriersäure ist etwa viermal größer, als man bei dem Gemisch theoretisch annehmen würde. Dieser Hinweis lässt sich so interpretieren, dass vier neue Spezies für die Gefrierpunktserniedrigung verantwortlich sein müssen. Die Oxoniumionen generieren das stark saure Milieu, welches das Nitroniumion stabilisiert.
Das entstandene Nitroniumion ist in einigen gut spektroskopisch untersuchten Verbindungen isolierbar (z. B. (NO2)(BF4) oder (NO2)(S2O7H)).
Ein erster Hinweis auf den vermuteten Mechanismus lieferten Analysen zur Kinetik der Reaktion. Man fand folgende Geschwindigkeitsgleichung für die Reaktion:
k ist hierbei eine reaktionsspezifische Geschwindigkeitskonstante. Anhand dieser Gleichung wird deutlich, dass einerseits Ar–H (wobei Ar ein beliebiger Arylrest sei) als auch +NO2 an der Gesamtreaktionsgeschwindigkeit beteiligt sind.
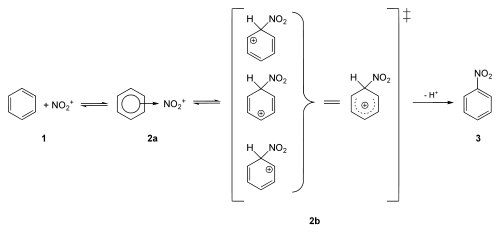
Der Aromat (1) tritt in lose Wechselwirkung mit dem Nitroniumion, das auch als π-Komplex bezeichnet wird (2a). Daraus bildet sich der sogenannte Sigma-Komplex, dessen positive Ladung über den Ring delokalisiert ist (2b). Die auftretenden Zwischenstufen werden auch als Wheland-Komplex bezeichnet. Bei diesem Vorgang wird die Aromatizität aufgehoben. Schließlich erfolgt eine Deprotonierung des Sigma-Komplexes, so dass der nitrierte Aromat freigesetzt wird (3).
Literatur
Peter Sykes, "Wie funktionieren organische Reaktionen?", Wiley-VCH, 2001 (2. Auflage), S. 36 ff.
Wikimedia Foundation.


![Geschwindigkeit = k \ \mathrm{[Ar{-}H][^+NO_2] \!\,}](e/23ee90cb35dd68e3c91ffc4de2d546a8.png)