- Oxidationszahl
-
Die Oxidationszahl Nox (auch Oxidationsstufe, Oxidationswert, elektrochemische Wertigkeit) gibt an, wie viele Elementarladungen ein Atom innerhalb einer Verbindung formal aufgenommen bzw. abgegeben hätte, wenn alle Nachbaratome mit ihren gemeinsamen Elektronenpaaren entfernt würden. Sie entspricht somit der hypothetischen Ionenladung eines Atoms in einem Molekül bzw. der tatsächlichen Ladung einatomiger Ionen.[1]
Eine andere Definition lautet: Die Oxidationszahl eines Atoms in einer chemischen Verbindung ist formal ein Maß zur Angabe der Verhältnisse der Elektronendichte um dieses Atom. Eine positive Oxidationszahl zeigt an, dass die Elektronendichte gegenüber seinem Normalzustand verringert ist, eine negative zeigt an, dass die Elektronendichte um das Atom erhöht ist.
Die Oxidationszahl ist ein für chemische Überlegungen wie z. B. Redoxreaktionen nützlicher Formalismus, der oftmals nur wenig mit der realen Ladung eines Atoms zu tun hat. Es kann durchaus vorkommen, dass Atomen in einer Verbindung eine negative formale Oxidationszahl zugeordnet wird, obwohl sie gleichzeitig eine positive Formalladung tragen. Die Oxidationszahl unterscheidet sich in kovalenten Verbindungen oft vom Begriff der Bindigkeit („Bindungswertigkeit“).
Inhaltsverzeichnis
Nutzen
Die Oxidationszahlen dienen bei Redoxreaktionen dazu, die Vorgänge besser zu erkennen. Die Übertragung der Elektronen von einem Atom auf ein anderes zeigt sich daran, dass sich die Oxidationszahl des einen (das Elektronen abgibt) erhöht, die des anderen (das Elektronen aufnimmt) verringert. Oft wird erst durch die Bestimmung der Oxidationszahlen einzelner Atome klar, welche chemische Reaktion abläuft.
Angabe der Oxidationszahl
Ganzzahlige Oxidationszahlen werden in Verbindungen in römischen Ziffern über die Atomsymbole geschrieben.[1]
Beispiel Wasser:

Steht das Elementsymbol alleine, so werden sie häufig als arabische Ziffern wie bei Ionen geschrieben.
Bestimmung der Oxidationszahl
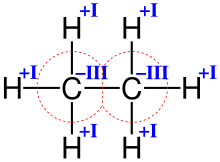 Bestimmung der Oxidationszahlen von Kohlenstoff und Wasserstoff in Ethan
Bestimmung der Oxidationszahlen von Kohlenstoff und Wasserstoff in Ethan
Hauptregeln
Die Oxidationszahl lässt sich mit Hilfe folgender Regeln herleiten:
- Atome im elementaren Zustand haben immer die Oxidationszahl 0 (z. B. I2, C, O2, P4, S8, 0 ist aber auch in Verbindungen mit anderen Elementen möglich).
- Bei einatomigen Ionen entspricht die Oxidationszahl der Ionenladung (z. B. Cu2+ hat die Oxidationszahl +II, Ag+ hat die Oxidationszahl +I).
- Die Summe der Oxidationszahlen aller Atome einer mehratomigen neutralen Verbindung ist gleich 0.
- Die Summe der Oxidationszahlen aller Atome eines mehratomigen Ions ist gleich der Gesamtladung dieses Ions.
- Bei kovalent formulierten Verbindungen (so genannten Valenzstrichformeln, Lewis-Formeln) wird die Verbindung formal in Ionen aufgeteilt. Dabei wird angenommen, dass die an einer Bindung beteiligten Elektronen vom elektronegativeren Atom vollständig übernommen werden.
- Die meisten Elemente können in mehreren Oxidationsstufen auftreten.
Hilfsregeln
In der Praxis hat es sich als hilfreich erwiesen, für die Bestimmung der Oxidationszahlen einige Regeln zu formulieren:
- Das Fluoratom (F) als Element mit höchster Elektronegativität bekommt in Verbindungen immer die Oxidationszahl −I.
- Sauerstoffatome bekommen die Oxidationszahl −II. Mit 3 Ausnahmen: In Peroxiden (dann: −I) und in Hyperoxiden (dann −0,5) und in Verbindung mit Fluor (dann: +II).
- Weitere Halogenatome (wie Chlor, Brom, Iod) haben im Allgemeinen die Oxidationszahl (−I), außer in Verbindung mit Sauerstoff oder einem Halogen, das im Periodensystem höher steht.
- Metallatome bekommen in Verbindungen als Ionen immer eine positive Oxidationszahl.
- Alkalimetalle haben stets +I und Erdalkalimetalle stets +II als Oxidationszahl.
- Wasserstoffatome bekommen die Oxidationszahl +I, außer wenn Wasserstoff mit „elektropositiveren“ Atomen wie Metallen (Hydride) oder sich selbst direkt verbunden ist.
- In ionischen Verbindungen (Salzen) ist die Summe der Oxidationszahlen identisch mit der Ionenladung.
- In kovalenten Verbindungen (Molekülen) werden die Bindungselektronen dem elektronegativeren Bindungspartner zugeteilt. Gleiche Bindungspartner erhalten je die Hälfte der Bindungselektronen. Die Oxidationszahl entspricht somit den zugeteilten Bindungselektronen im Vergleich zu der Anzahl der normalerweise vorhandenen Außenelektronen.
- Die höchstmögliche Oxidationszahl eines Elementes entspricht der Haupt- bzw. Nebengruppenzahl im Periodensystem (PSE)
Siehe auch
Einzelnachweise
- ↑ a b A. D. McNaught, A. Wilkinson: Compendium of Chemical Terminology (IUPAC Recommendations: "Gold Book"). 2. Auflage. Blackwell Scientific Publications, Oxford 1997, doi:10.1351/goldbook.O04363.
Weblinks
 Wikibooks: Anorganische Chemie für Schüler/ Redoxreaktionen als Elektronenübergänge – Lern- und LehrmaterialienKategorie:
Wikibooks: Anorganische Chemie für Schüler/ Redoxreaktionen als Elektronenübergänge – Lern- und LehrmaterialienKategorie:- Chemische Größe
Wikimedia Foundation.
