- P-Nitrobenzaldehyd
-
Nitrobenzaldehyde Name 2-Nitrobenzaldehyd 3-Nitrobenzaldehyd 4-Nitrobenzaldehyd Andere Namen o-Nitrobenzaldehyd m-Nitrobenzaldehyd p-Nitrobenzaldehyd Strukturformel 
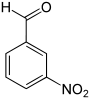
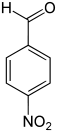
CAS-Nummer 552-89-6 99-61-6 555-16-8 PubChem 11101 7449 541 Summenformel C7H5NO3 Molare Masse 151,12 g·mol−1 Aggregatzustand fest Kurzbeschreibung leicht gelbes kristallines Pulver Schmelzpunkt 41–43 °C[1] 55 °C[2] 103–106 °C[3] Siedepunkt 156 °C[1] 285–290 °C[2] –[3] Gefahrstoff-
kennzeichnung
[1][2][3]
Gesundheits-
schädlich(Xn) 
Gesundheits-
schädlich(Xn) 
Umwelt-
gefährlich(N) 
Reizend (Xi) R-Sätze 22-36/37/38 22-51/53 36-43-52/53 S-Sätze 26 29-61 26-36/37-61 Die Nitrobenzaldehyde bilden eine Stoffgruppe, die sich sowohl vom Benzaldehyd als auch vom Nitrobenzol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter Aldehyd- (–CHO) und Nitrogruppe (–NO2). Durch deren unterschiedliche Anordnung ergeben sich drei Konstitutionsisomere. Je nach Position spricht man von ortho-, meta- oder para-Nitrobenzaldehyd.
Inhaltsverzeichnis
Darstellung
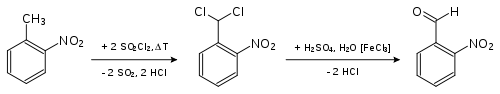
- 2-Nitrotoluol wird in der Hitze chloriert. Das entstandende 2-Nitrobenzylidendichlorid wird verseift, wobei 2-Nitrobenzaldehyd entsteht.
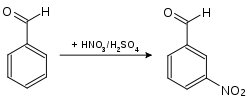
- 3-Nitrobenzaldehyd erhält man aus Benzaldehyd durch Umsetzung mit rauchender Salpetersäure in Gegenwart von konzentrierter Schwefelsäure.[4][5][6]
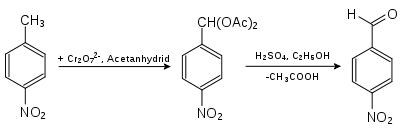
- 4-Nitrobenzaldehyd erhält man aus 4-Nitrotoluol durch Oxidation mit Chrom(VI)-oxid in Acetanhydrid. Das entstehende 4-Nitrobenzaldiacetat wird mit Schwefelsäure in wässrigem Ethanol hydrolysiert.[7]
Eigenschaften
Die Nitrobenzaldehyde sind leicht gelbe kristalline Feststoffe, die zum Teil bittermandelartig riechen. Der 4-Nitrobenzaldehyd, der die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt.
Im basischen Medium disproportionieren die Nitrobenzaldehyde zu Nitrobenzoesäuren und Nitrobenzylalkoholen.
Verwendung
- 2-Nitrobenzaldehyd wird als Reagenz auf Isopropanol und Aceton verwendet.
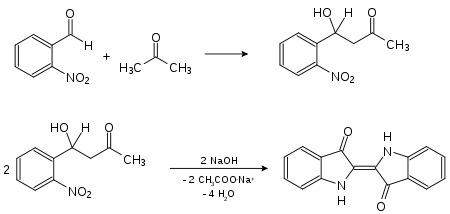
- Adolf von Baeyer patentierte 1883 einen Syntheseweg zu Isatin aus 2-Nitrobenzaldehyd. Infolgedessen musste Indigo nicht mehr umständlich aus Pflanzen gewonnen werden.
Einzelnachweise
- ↑ a b c Eintrag zu o-Nitrobenzaldehyd in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 20. Januar 2009 (JavaScript erforderlich).
- ↑ a b c Eintrag zu m-Nitrobenzaldehyd in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 20. Januar 2009 (JavaScript erforderlich).
- ↑ a b c Daten der Firma Sigma-Aldrich; abgerufen am 20. Januar 2009.
- ↑ IOC-Praktikum: Nitrierung von Benzaldehyd zu 3-Nitrobenzaldehyd.
- ↑ OC-Praktikum: Nitrierung von Benzaldehyd zu 3-Nitrobenzaldehyd.
- ↑ Uni Hamburg: 3-Nitrobenzaldehyd, Versuchsvorschrift.
- ↑ 4-Nitrobenzaldehyd, Versuchsvorschrift aus: Organic Syntheses, Coll. Vol. 2, p. 441 (1943); Vol. 18, p. 61 (1938).
- ↑ Laborversuch Indigo (www.experimentalchemie.de).
Siehe auch
Wikimedia Foundation.