- Polyphosphide
-
Polyphosphide sind Polyphosphorverbindungen, bei denen die Phosphoratome als anionische Käfigstrukturen vorliegen (sogenannte Polyanionen). Die Verbindungen sind äußerst instabil und nur bei Temperaturen des flüssigen Ammoniaks (−33,4 °C bis −77,4 °C) stabil und nachweisbar.
Inhaltsverzeichnis
Herstellung
Polyphosphide sind aus Diphosphan durch Deprotonierung unter schonender Oxidation darstellbar. Bei der direkten Umsetzung von Metallen mit weißem oder rotem Phosphor bei hohen Temperaturen und unter Luftausschluss entstehen nicht-polymere Phosphide.[1]
Bekannte Polyphosphide
Einige Polyphosphide[2] ![Die Struktur des [P7]3− -Anions](/pictures/dewiki/49/101px-Metallphosphid_P3_7.svg.png)
![Das komplexe [P11]3− -Anion](/pictures/dewiki/49/151px-Metallphosphid_P3_11.svg.png)
P73− P113− ![[P14]4− ist aus zwei verbrückten [P7]3−-Käfigen aufgebaut](/pictures/dewiki/49/151px-Metallphosphid_P4_14.svg.png)
![[P22]4− ist aus zwei verbrückten [P11]3−-Käfigen aufgebaut](/pictures/dewiki/49/151px-Metallphosphid_P4_22.svg.png)
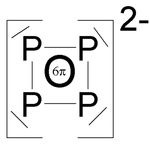
P144− P224− - P42− besitzt aromatischen Charakter, ist daher ein planarer Ring mit einem P−P−P-Bindungswinkel von ~ 90° (Beispiel Cs2P4 ·2 NH3, P−P-Bindungslängen 215 pm).[2]
- P5−
- P64−
- P73− bildet eine Käfigstruktur mit einem gleichseitigen P3-Dreieck als Grundfläche, das von einer trigonalen P4-Pyramide als „Kopf“ überbrückt wird. Dieses Strukturelement kann auch bei höheren Homologen auftreten ([P7−]
 )[2]
)[2] - P113−
- P144− entspricht einem Dimer aus P73−, wobei zwei der "Kopf"-Phosphoratome verbunden sind.[2]
- P162−
- P193−
- P213−
- P30N5− [3] Der Phosphidkäfig enthält ein zentrales Stickstoffatom aus dem Lösungsmittel Ammoniak. Das Anionengerüst liegt im Festkoerper als Dimer vor.
- P224− ist aus zwei verbrückten P113−-Käfigen aufgebaut
Chemische Eigenschaften
Polyphosphide können durch schonende Protonierung in flüssigem Ammoniak in die entsprechenden Hydrogenpolyphosphide überführt werden. Diese stellen damit die Bindeglieder zu den Polyphosphanen dar. Kettenförmige Polyphosphide sind isoelektronisch zu den entsprechenden Polysulfiden und ähneln diesen in ihrer Struktur.[1]
Siehe auch: Polysulfide
Weblinks
- Polyphosphide und Hydrogenpolyphosphide (PDF; 131 kB)
Einzelnachweise
- ↑ a b Holleman, Wiberg: Inorganic Chemistry. Elsevier, 2001, ISBN 0-12352651-5, S.686–688
- ↑ a b c d A.F. Holleman, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 755–757.
- ↑ H. Graf: Dissertation, Universität Karlsruhe(TH), 1998.
Kategorien:- Phosphorverbindung
- Stoffgruppe
Wikimedia Foundation.