- Propan-1,3-diol
-
Strukturformel 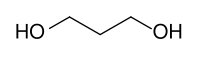
Allgemeines Name 1,3-Propandiol Andere Namen - Propan-1,3-diol
- Trimethylenglycol
- 1,3-Dihydroxypropan
Summenformel C3H8O2 CAS-Nummer 504-63-2 PubChem 10442 Kurzbeschreibung farblose Flüssigkeit[1] Eigenschaften Molare Masse 76,10 g·mol−1 Aggregatzustand flüssig
Dichte 1,05 g·cm−3 (20 °C)[1]
Schmelzpunkt Siedepunkt 213 °C[1]
Dampfdruck Löslichkeit mäßig in Wasser (100 g/l bei 20 °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze WGK 1[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 1,3-Propandiol (PDO) ist eine chemische Verbindung. Sie besteht aus dem Grundgerüst des Propans, an dessen terminalen Positionen sich jeweils eine Hydroxylgruppe befindet. 1,3-Propandiol gehört zur Gruppe der zweiwertigen Alkohole, der Diole.
Inhaltsverzeichnis
Herstellung
1,3-Propandiol ist über eine Vielzahl von Möglichkeiten synthetisch zugänglich. Eine Möglichkeit besteht in der Umsetzung von Acrolein mit Hydrochinon und verdünnter Schwefelsäure und anschließender Reduktion mit Raney-Nickel als Katalysator.[2]
Eine biochemische Synthese kann durch die Vergärung von Glycerin durch Bakterien der Gattung Citrobacter und Aerobacter bewerkstelligt werden.[2]Eigenschaften
Es handelt sich um eine farblose Flüssigkeit mit nur schwachem Eigengeruch, die bei 213 °C siedet. Der Brechungsindex beträgt bei einer Temperatur von 20 °C und einer Wellenlänge von 589 nm 1,4383.[3]
Verwendung
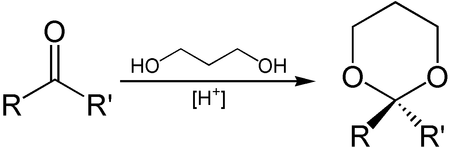
1,3-Propandiol kann zur Einführung von Schutzgruppen an Aldehyden und Ketonen genutzt werden.[4] Aus der eingesetzten Carbonylverbindung wird so ein Derivat von 1,3-Dioxan, ein Acetal beziehungsweise Ketal, gebildet. Dieses ist stabil gegenüber basischen Bedingungen und kann wenn sie nicht mehr benötigt wird durch Einwirkung von Brønstedt- oder Lewis-Säuren in Anwesenheit von Wasser wieder gespalten werden.
Auch die Synthese von 1,3-Dioxan selbst gelingt durch Umsetzung von 1,3-Propandiol mit Formaldehyd und Phosphorsäure.[5] Diese Reaktion kann auch unter Verwendung von Salzsäure und Urotropin durchgeführt werden.[6]
Quellen
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 504-63-2 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 26. Juli 2008 (JavaScript erforderlich)
- ↑ a b C. H. Werkman, G. F. Gillen: Bacteria Producing Trimethylene Glycol, in: J. Bacteriol. 1932, 23, 167–182.
- ↑ M. Bergmann, A. Miekeley, E. v. Lippmann: Zur Chemie assoziierender Lactolide: Über Umwandlungen der Aldole, in: Chem. Ber. 1929, 62, 1467–1474. doi:10.1002/cber.19290620616
- ↑ E. J. Salmi: Untersuchungen über ätherartige Verbindungen, I. Mitteil.: Zur Darstellung der Acetale und Ketale, in: Chem. Ber., 1938, 71, 1803–1808. doi:10.1002/cber.19380710905
- ↑ R. Leutner: Zur Hydrolysegeschwindigkeit zyklischer Azetale, in: Monatsh. Chem. 1932, 60, 317–352. ISSN 0343-7329, doi:10.1007/BF01538573
- ↑ US-Patent ICI, US 2021680, 1930.
Wikimedia Foundation.