- Redoxtitration
-
Die Redoxtitration ist in der Chemie eine Konzentrationsbestimmungsmethode durch Titration. Mit ihr lässt sich der Gehalt an Stoffen bestimmen, die sich oxidieren oder reduzieren lassen.
Inhaltsverzeichnis
Grundlagen
Bei der Oxidimetrie lässt man die zu bestimmende Substanz mit einer oxidierenden oder reduzierenden Maßlösung reagieren (Redoxreaktion). Sobald die zu bestimmende Substanz durch allmähliches Hinzutropfen der Maßlösung vollständig oxidiert oder reduziert ist, findet der nächste Tropfen der Maßlösung keinen Reaktionspartner mehr vor. Das Verschwinden der zu bestimmenden Substanz oder die nun in der Probe überschüssige Maßlösung muss als Endpunkt der Reaktion erkannt werden, um die bis dahin verbrauchte Menge an Maßlösung feststellen zu können.
Häufig angewandte Methoden sind die Bromatometrie, bei der Bromationen als Oxidationsmittel verwendet werden:
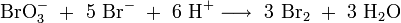
- Synproportionierung von Bromationen (Oxidationsstufe: +5) und Bromidionen (Oxs.: -1) zu Brom (Oxs.: 0)
die Manganometrie, welche Permanganationen als Oxidationsmittel verwendet:
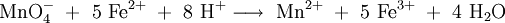
- Redox-Titration von Permangantionen (Oxs.: +7) mit Eisen(II)-ionen.
sowie die Cerimetrie, bei der vierwertige Cerionen zur Oxidation eingesetzt werden:
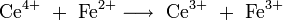
- Oxidation von Eisen(II)-ionen mit Cer(IV)-ionen.
Erkennung des Reaktionsendpunktes
Durch Eigenindikation
Die Eigenindikation wird vor allem in der Manganometrie (KMnO4) und Iodometrie (allerdings durch Zugabe von Stärke, da Iod mit Stärke einen farbigen Komplex ausbildet) ausgenutzt, weil Kaliumpermanganat- und Iodlösung farbige Lösungen sind.
Während der direkten Titration wird die zugesetzte Maßlösung durch die Reaktion mit der Probe laufend entfärbt. Ist die Reaktion beendet, d. h. alle Probensubstanz hat reagiert, wird die Maßlösung nicht mehr umgesetzt und färbt deshalb die Titrationslösung.
Mit Hilfe von Redoxindikatoren
Redoxindikatoren sind Substanzen, die selbst oxidiert bzw. reduziert werden und deshalb eine Farbänderung zeigen. z. B. Ferroin. Auch nicht redoxaktive Substanzen können als Indikatoren wirken, z. B. zeigt in der Bromatometrie die Entfärbung durch Zerstörung eines Farbstoffes den Endpunkt der Reaktion an.
Potentiometrisch
Während einer Redoxtitration verändert sich die Spannung zwischen der Probelösung und einer Elektrode. Bei der potentiometrischen Methode trägt man diese gemessene Spannung in Abhängigkeit zum zugegebenen Volumen Maßlösung auf, so erhält man eine Titrationskurve, die grafisch oder rechnerisch ausgewertet werden kann.
Quellen
- G.-O. Müller: Quantitativ-anorganisches Praktikum. 7. Auflage, Verlag Harri Deutsch, Frankfurt/Main 1992, ISBN 3-8171-1211-4.
Weblinks
Wikimedia Foundation.
