- Robinson-Anellierung
-
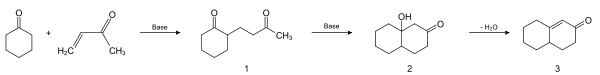
Die Robinson-Anellierung ist nach dem britischen Chemiker und Träger des Nobelpreises für Chemie Robert Robinson benannt. Sie wird zu den Namensreaktionen der organischen Chemie gezählt und ermöglicht es, organische Verbindungen um einen Sechsring zu erweitern. Dies wird durch eine Sequenz aus einer Michael-Addition und anschließender Aldolkondensation ermöglicht. Andere Ringgrößen sind nicht möglich.[1]
Nach Abschluss der Reaktion entsteht wieder eine ungesättigte Carbonylverbindung, die als sogenannter Michaelakzeptor als Ausgangspunkt für eine weitere Robinson-Anellierung dienen kann. Diese Methode eignet sich insbesondere zum Aufbau von Steroidgerüsten.
Das Cyclohexanon-Derivat wird zunächst in einer Michael-Addition basenkatalysiert zum 1,5-Diketon 1 umgesetzt. Dieses reagiert wiederum basenkatalysiert in einer Aldolreaktion (Mechanismus siehe dort) zum β-Hydroxyketon 2, das unter Wasserabspaltung das α,β-ungesättigte Keton 3 ergibt.[2]
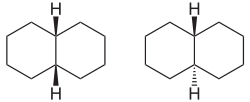
Als Anellierte Ringe bezeichnet man generell aneinander verknüpfte, cyclische Systeme – wie bei den beiden Decalin-Isomeren – mit mindestens zwei gemeinsamen Atomen in beiden Ringen:
Varianten
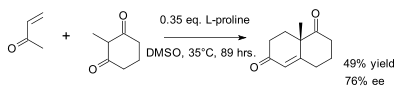
Das Wieland Miescher Keton ist racemisch.[3] Die Robinson-Anellierung kann mit Hilfe von L- oder D-Prolin steroselektiv durchgeführt werden[4]
Literatur
- Bergmann, E. D.; Gingberg, D.; Pappo, R. Org. React. 1959, 10, 179.
Einzelnachweise
- ↑ Rapson, William Sage; Robinson, Robert: In 307. Experiments on the synthesis of substances related to the sterols. Part II. A new general method for the synthesis of substituted cyclohexenones, Journal of the Chemical Society 1935, 1285 doi:10.1039/JR9350001285.
- ↑ Organikum, 16. Auflage, VEB Deutscher Verlag der Wissenschaften Berlin 1985, S.511, ISBN 3-326-00076-6.
- ↑ Wieland, P.; Miescher, K.: In Über die Herstellung mehrkerniger Ketone., Helv. Chim. Acta 1950, 33, 2215. doi:10.1002/hlca.19500330730.
- ↑ Hajos, Zoltan G., Parrish, David R. Deutsche Offenlegungsschrift 2102623 21, ,Januar 1970.
Wikimedia Foundation.