- Shikimat
-
Strukturformel 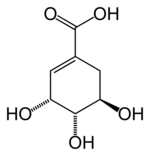
Allgemeines Name Shikimisäure Andere Namen (3R,4S,5R)-3,4,5-Trihydroxy- 1-cyclohexencarbonsäure
Summenformel C7H10O5 CAS-Nummer 138-59-0 Kurzbeschreibung farblose, nadelförmige Kristalle Eigenschaften Molare Masse 174,15 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit 180 g·l−1 in Wasser (20 °C) [2]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Shikimisäure ist ein wichtiges biochemisches Intermediat im Stoffwechsel von Pflanzen und Mikroorganismen. Das Naturprodukt ist die (3R,4S,5R)-Shikimisäure. Die anderen sieben möglichen Stereoisomeren der Shikimisäure besitzen keine Bedeutung.
Inhaltsverzeichnis
Geschichte
Shikimisäure wurde erstmals 1885 von Johan Fredrik Eykman aus dem Japanischen Sternanis (Illicium anisatum) isoliert, der auf japanisch Shikimi (シキミ/樒) heißt.[3][4]
Gewinnung und Darstellung
Shikimisäure ist ein wichtiges Zwischenprodukt in der Biosynthese der für den Menschen essentiellen aromatischen Aminosäuren L-Tyrosin, L-Tryptophan und L-Phenylalanin bei Pflanzen und Mikroorganismen. Ihre Salze heißen Shikimate.
Die Shikimisäure ist ein wichtiges Stoffwechselzwischenprodukt der Pflanzen und daher weit verbreitet. Sie kommt in großen Mengen in der giftigen Shikimifrucht sowie im verwandten, aber ungiftigen Sternanis vor.
Von der Shikimisäure leiten sich zahlreiche in Pflanzen vorkommende Aromaten ab, zum Beispiel die Protocatechusäure. Ein anderer Weg führt zu Gallussäure, die Bestandteil der hydrolisierbaren Gerbstoffe ist.
Shikimisäureweg
Der Shikimisäureweg stellt einen wichtigen Weg für die Biogenese von Aromaten dar.[5] Der Shikimisäureweg findet jedoch nicht in höheren Tieren statt.
Der Shikimisäureweg beginnt eigentlich nicht mit der Shikimisäure. Die Biosynthese beginnt mit der Reaktion von D-Erythrose-4-phosphat mit Phosphoenolpyruvat (PEP). Erst in weiteren Schritten entstehen dann Dehydrochinasäure, Dehydroshikimisäure, Shikimisäure und Chorisminsäure. Bei Chorismat teilt sich die Biosynthese dann in zwei Wege. In dem einen Weg entsteht L-Tryptophan, in dem anderen über Prephenat als Zwischenstufe L-Tyrosin und L-Phenylalanin. Der Shikimisäureweg ist nicht nur für den Proteinaufbau in Pflanzen wichtig, ausgehend von der beim Shikimisäureweg gebildeten α-Aminosäure, sondern auch für die Biosynthese der Cumarine und Flavonoide.
Anwendung
Aus Shikimisäure kann in einer neunstufigen Synthese Oseltamivir, der Wirkstoff des Grippemedikaments Tamiflu®, dargestellt werden. Der nicht ganz ungefährlich verlaufende Syntheseweg, die geringe Gesamtausbeute von etwa 35 Prozent und die aufwändige Gewinnung des Rohstoffs Shikimisäure erschweren es derzeit, Oseltamivir in ausreichend großen Mengen zu produzieren.
Stereoisomere
Natürliche Shikimisäure besitzt die (3R,4S,5R)-Konfiguration. Die anderen sieben Stereoisomeren [(3S,4R,5S)-, (3R,4R,5S)-, (3S,4S,5R)-, (3R,4S,5S)-, (3S,4R,RS)-,(3S,4S,5S)- und die (3R,4R,5R)-Shikimisäure] besitzen keine praktische Bedeutung. Das Racemat aus (3R,4S,5R)- und (3S,4R,5S)-Shikimisäure besitzt einen Schmelzpunkt von 191-192 °C.[1]
Quellen
- ↑ a b The Merck Index, 9. Auflage, 1976, ISBN 0-911910-26-3, S. 1097.
- ↑ a b Sicherheitsdatenblatt der Firma Carl Roth
- ↑ Eykman, J.F. (1885). In: Recl. Trav. Chim. Pays-Bas. Bd. 4, S. 32.
- ↑ Jiang, S. und Singh, G. (1998): Chemical synthesis of shikimic acid and its analogues. In: Tetrahedron. Bd. 54, S. 4697. PDF
- ↑ Shikimisäure-Biosynthese (englisch)
Weblinks
Wikimedia Foundation.
