- Stereoselektivität
-
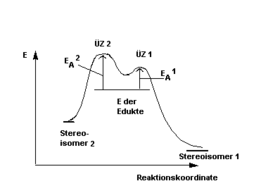
Eine Reaktion ist stereoselektiv, wenn mehrere Stereoisomere als Reaktionsprodukte entstehen können, sich allerdings die Übergangszustände zu den einzelnen Stereoisomeren in ihrer Energie unterscheiden.
Der Übergangszustand mit der niedrigsten Energie, folglich der Reaktionsweg mit der niedrigsten Aktivierungsenergie, wird dann, bei ausreichend niedriger Temperatur, bevorzugt durchlaufen, so dass ein Stereoisomer bevorzugt gebildet wird. Man spricht dann von diastereotopen Übergangszuständen (s. Schema). Das Ausmaß der Stereoselektivität hängt entscheidend von der energetischen Differenz der Übergangszustände und der Reaktionstemperatur ab. Diastereotope Übergangszustände können sich nur dann entwickeln, wenn wenigstens einer der Reaktionspartner chiral ist (induzierte Stereoselektivität). Enzyme wirken als stereoselektive Katalysatoren indem sie gezielt die Energie eines spezifischen Übergangszustands absenken. Ein Beispiel für eine stereoselektive Reaktion der organischen Synthesechemie ist die Sharpless-Epoxidierung.
Sind zwar theoretisch mehrere Stereoisomere als Reaktionsprodukte denkbar, wird aber ausschließlich ein Übergangszustand durchlaufen, nennt man die Reaktion stereospezifisch. Ein einfaches Beispiel ist die nukleophile Substitution nach SN2 mit Walden-Umkehr.
Siehe auch
Wikimedia Foundation.