- Sharpless-Epoxidierung
-
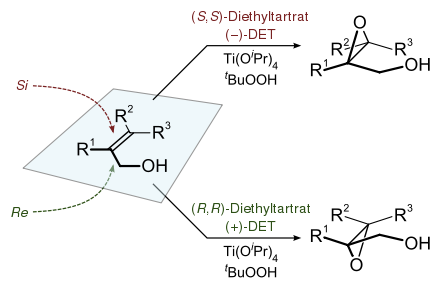
Die Sharpless-Epoxidierung ist eine Namensreaktion in der organischen Synthesechemie. Sie gehört zur Gruppe der katalytisch asymmetrischen Reaktionen. Die Reaktion liefert 2,3-Epoxyalkohole aus Allylalkoholen. Diese Produkte enthalten sowohl Epoxid- als auch Alkoholgruppen und dienen als Ausgangsprodukte für zahlreiche weitere Stoffe. Ein hoher präparativer Nutzen liegt auch darin, dass selektiv nur ein Enantiomer gebildet wird, es handelt sich um eine enantio- und diastereoselektive Reaktion.
Barry Sharpless erhielt für diese und andere Reaktionen im Jahr 2001 zusammen mit William S. Knowles und Ryoji Noyori den Nobelpreis für Chemie.
Inhaltsverzeichnis
Reaktionsbedingungen
Typischerweise wird die Sharpless-Epoxidierung[1] bei −78 °C in Dichlormethan durchgeführt. Das Substrat ist ein primärer oder sekundärer Allylalkohol. Das oxidierende Agens ist ein Hydroperoxid, meistens das tert-Butylhydroperoxid. Der Komplex, der die Stereoselektivität induziert, bildet sich aus in katalytischen Mengen zugesetztem Titan(IV)-isopropylalkoholat (Titan(IV)-isopropoxid, 5 bis 10 mol %) und enantiomerenreinen Weinsäurediethylester (Diethyltartrat [DET], 6 bis 12 mol %). Der Zusatz von Molekularsieb (3 oder 4 Å) verringert erstaunlicherweise die Menge an Katalysator, die eingesetzt werden muss.
Man legt in −78 °C kaltem Dichlormethan, Molsieb, Titanisopropoxid und Tartrat vor, rührt eine Weile und gibt dann tert-Butylhydroperoxidlösung und das Substrat zu. Nach der Reaktion wird mit schwach saurer, reduzierender Lösung gequencht. Hierfür eignet sich z. B. Eisen(II)-chlorid und Weinsäure in Wasser. Das Eisen reduziert Peroxide, während die Weinsäure Titan komplexieren und in die wässrige Phase überführen kann. Stark saure Aufarbeitung kann zur Epoxidöffnung führen.
Mechanismus
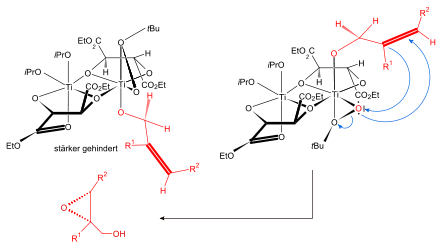 Übergangszustand[2] bei der Sharpless-Epoxidierung
Übergangszustand[2] bei der Sharpless-Epoxidierung
Die enantioselektive Epoxidierung verläuft ausgehend von einem achiralen/prochiralen Edukt (Allylalkohol) mit Hilfe eines chiralen Katalysators, bestehend aus DET und Titan(IV)-isopropylat (Titantetraisopropoxid).
Dazu wird zunächst aus Titan(IV)-isopropylat und dem optisch aktiven Weinsäurediethylester, im Beispiel (S,S), der höchstwahrscheinlich als Dimer vorliegende chirale Katalysator generiert, wobei zwei Äquivalente Isopropanol freigesetzt werden. Die beiden verbliebenen Isopropanolat-Reste werden im folgenden Reaktionsverlauf durch das Oxidationsmittel (tert-Butylhydroperoxid) und den Allylalkohol substituiert, wodurch ein „Komplex“ aus chiralen Katalysator, Allylalkohol und Epoxidierungsreagenz entsteht. Dieser Komplex hat eine bevorzugte Geometrie. Die Titan(IV)-alkoxid Spezies wirkt als Lewis-Säure, indem sie das O²-Atom koordinativ bindet und somit das verbleibende Peroxosauerstoffatom Elektrophil aktiviert. Das Peroxosauerstoffatom wird an die Doppelbindung addiert. Nach wässriger Aufarbeitung (Hydrolyse) wird das (2R)-Epoxid sowie tert-Butanol erhalten. Alternativ gelangt man zum (2S)-Epoxid durch Verwendung von (R,R)-Weinsäurediethylester.
Alternative Reaktionen
Da sich die Sharpless-Epoxidierung ausschließlich auf Allylalkohole beschränkt, können gewöhnliche, nicht funktionalisierte Olefine (Alkene) alternativ durch die Jacobsen-Katsuki-Epoxidierung mit optisch aktiven Mn(III)-Komplexen oder die Shi-Epoxidierung mit Kaliumperoxomonosulfat zu Epoxiden (Oxiranen) umgesetzt werden.
Siehe auch
Literatur
- Herbert Waldmann: Organic synthesis highlights II. Ausgabe 2, Wiley-VCH, 1995, ISBN 3527293787, S. 3–8 (Digitalisat).
- Jie Jack Li: Sharpless asymmetric epoxidation, in: Name Reactions, Springer, Berlin/Heidelberg 2006. ISBN 978-3-540-30031-1, 533–535, doi:10.1007/3-540-30031-7_243.
Weblinks
 Commons: Sharpless-Epoxidierung – Sammlung von Bildern, Videos und Audiodateien
Commons: Sharpless-Epoxidierung – Sammlung von Bildern, Videos und Audiodateien- Sharpless-Epoxidierung unter organische-chemie.ch (deutsch)
- Sharpless-Epoxidierung unter organic-chemistry.org (englisch)
Einzelnachweise
- ↑ Tsutomu Katsuki, K. Barry Sharpless: The first practical method for asymmetric epoxidation. In: Journal of the American Chemical Society. 102, Nr. 18, 1980, S. 5974–5976, doi:10.1021/ja00538a077.
- ↑ [1]
Wikimedia Foundation.