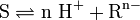- Säurerest
-
Ein negativ geladenes Ion heißt Anion [ˈanioːn] (sprich: An-Ion). Da negativ geladene Ionen bei einer Elektrolyse zur Anode (dem Pluspol) wandern, wurde für sie der Name Anion gewählt. Anionen entstehen aus Atomen bzw. Molekülen durch Elektronenaufnahme.
Jedes Anion - z. B. Oxid- (O2−) oder Sulfid-Anion (S2−) - kann durch Kombination mit verschiedenen Kationen unterschiedliche Verbindungen bilden, so dass sich von den stabilen Anionen ganze Verbindungsklassen (im Beispiel die Oxide und Sulfide) ableiten. Oxide und Sulfide bilden viele Gesteine und Erze und sind damit in der Mineralogie und Metallurgie besonders bedeutend. Alle Salze lassen sich nach den vorhandenen Anionen in Stoffklassen einteilen. Der Begriff Sulfat hat somit zwei Aspekte: Er steht einmal für ein einzelnes Sulfation, aber auch für die Verbindungsklasse der Sulfate.
Zur qualitativen Identifikation von Anionen in Lösungen stehen in der Chemie Anionennachweise sowie moderne Labor-Geräte und Methoden der instrumentellen Analytik zur Verfügung.
Da jedes Atom und jedes Molekül unter geeigneten Bedingungen negativ geladen werden kann, kann es viele Millionen Anionen geben. Daher sollen nur wichtige Anionen mit einem Eintrag in der Wikipedia erläutert und in der folgenden Liste aufgeführt werden, etwa wenn sich von ihnen bedeutende Stoffklassen ableiten.
Inhaltsverzeichnis
Säurerest-Ionen
Säurerest-Ionen oder Säurereste leiten sich von den Säuren ab. Nach folgendem Schema gibt eine Säure S Protonen ab und es entsteht ein Säurerest Rn–:
Dieses Schema beschreibt keine Reaktion in einer Lösung.
Neben den vollständig deprotonierten Ionen wie S2−, SO42− und CO32− werden in der Literatur auch unvollständig deprotonierte Ionen wie HCO3− als Säurerest bezeichnet.
Einfache Elementanionen
Nach den Regeln der chemischen Nomenklatur endet der Name dieser Anionen auf -id. Sie sind auch in binären, d. h. aus zwei Elementen bestehenden Verbindungen enthalten, wobei bei der Benennung der Verbindung der anionische Teil zuletzt genannt wird, z. B. bei Natriumchlorid.
Anionen der 7. Hauptgruppe
Anionen der 6. Hauptgruppe
Anionen der 5. Hauptgruppe
Anionen der 4. Hauptgruppe
Anionen der 3. Hauptgruppe
- Borid Bx−
Komplexe Anionen
Sauerstoffhaltige Molekülanionen
Auch Oxo-Verbindungen genannt, z. B. kann Sulfat auch ausführlicher als Tetraoxosulfat bezeichnet werden, Sulfit als Trioxosulfat. Diese nach den Regeln der Komplexchemie gebildeten Namen sind aber unüblich.
7. Hauptgruppe
- Hypochlorit ClO−
- Chlorit ClO2−
- Chlorat ClO3−
- Perchlorat ClO4−
- Hypobromit BrO−
- Bromit BrO2−
- Bromat BrO3−
- Perbromat BrO4−
- Hypoiodit IO−
- Iodit IO2−
- Iodat IO3−
- Periodat IO4−
6. Hauptgruppe
- Hydroxid OH−
- Hydrogensulfid HS−
- Hydrogensulfit HSO3−
- Sulfit SO32−
- Hydrogensulfat HSO4−
- Sulfat SO42−
- Dithionat S2O62−
- Peroxodisulfat S2O82−
- Selenit SeO32−
- Selenat SeO42−
- Tellurat TeO42−
5. Hauptgruppe
- Nitrit NO2−
- Nitrat NO3−
- Dihydrogenphosphat H2PO4−
- Hydrogenphosphat HPO42−
- Phosphat PO43−
- Arsenat As043−
- Antimonat SbO43−
4. Hauptgruppe
- Hydrogencarbonat HCO3−
- Carbonat CO32−
- Silikat SiO44-
- Germanat
3. Hauptgruppe
- Borat BO33– bzw. B4O72–
Nebengruppen
- Chromat CrO42−
- Dichromat Cr2O72−
- Molybdat MoO42−
- Niobat
- Tantalat
- Permanganat MnO4−
- Perrhenat
- Rhenat
- Technetat
- Titanat
- Wolframat
- Zirkonat
Weitere Molekülanionen
- Cyanat OCN−
- Thiocyanat SCN−
- Thiosulfat S2O32−
- Cyanid CN−
- Amide NH2−
- Azid N3−
Halogenokomplexe
- Aluminiumtetrachlorid AlCl4−
- Hexachlorophosphat PCl6−
- Hexafluoroarsenat AsF6−
Organische Anionen
- Acetat (Anion bzw. Salz der Essigsäure)
- Butyrat (Anion bzw. Salz der Buttersäure)
- Citrat (Anion bzw. Salz der Zitronensäure)
- Formiat (Anion bzw. Salz der Ameisensäure)
- Fumarat (Anion bzw. Salz der Fumarsäure)
- Glutarat (Anion bzw. Salz der Glutarsäure)
- Lactat (Anion bzw. Salz der Milchsäure)
- Malat (Anion bzw. Salz der Äpfelsäure)
- Malonat (Anion bzw. Salz der Malonsäure)
- Oxalat (Anion bzw. Salz der Oxalsäure)
- Pyruvat (Anion bzw. Salz der Brenztraubensäure)
- Tartrat (Anion bzw. Salz der Weinsäure)
Quellen
- Römpp kompakt Basislexikon Chemie. Hrsg. von Jürgen Falbe und Manfred Regitz. Bearbeitet von Eckard Amelingmeier u.a. Thieme, Stuttgart/New York 1998, ISBN 3-13-115711-9
Wikimedia Foundation.