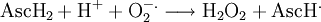- Askorbinsäure
-
Strukturformel 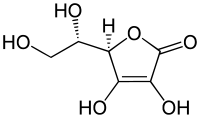
L-AscorbinsäureAllgemeines Trivialname Vitamin C Andere Namen - IUPAC: (5R)-5-[(1S)-1,2-Dihydroxyethyl]-3,4-dihydroxy-5-hydrofuran-2-on
- L-(+)-Ascorbinsäure
- E 300 (E-Nummer für Lebensmittelzusatzstoffe)
- 3-Oxo-L-gluconsäure-γ-lacton
- Hexuronische Säure (veraltet)
- Antiskorbut-Vitamin (veraltet)
Summenformel C6H8O6 CAS-Nummer 50-81-7 PubChem 5785 ATC-Code DrugBank DB00126 Kurzbeschreibung farb- und geruchloses Kristallpulver Vorkommen u. a. Obst, Gemüse, Grüntee Physiologie Funktion u. a. Radikalfänger, Cofaktor bei Mono- und Dioxidasereaktionen (insbes. Biosynthese von Collagen), Komplexierung von Metallkationen Täglicher Bedarf 100 mg Folgen bei Mangel Skorbut, Schwächung des Bindegewebes, Morbus Müller-Barlow bei Kleinkindern Überdosis 5–15 g/Tag Eigenschaften Molare Masse 176,13 g·mol−1 Aggregatzustand fest Dichte 1,65 g·cm−3[1] Schmelzpunkt 190–192 °C (Zersetzung)[1] Löslichkeit gut wasserlöslich, 330 g·l−1 bei 20 °C[1] Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ascorbinsäure ist ein farb- und geruchloser, kristalliner, gut wasserlöslicher Feststoff mit saurem Geschmack. Sie ist eine organische Säure (aber keine Carbonsäure); ihre Salze nennt man Ascorbate. Ascorbinsäure gibt es prinzipiell in vier verschiedenen stereoisomeren Formen. Biologische Aktivität weist jedoch nur die L-(+)-Ascorbinsäure auf. Ihre wichtigste Eigenschaft ist ihre physiologische Wirkung als Vitamin; ein Mangel kann sich bei Menschen durch Skorbut manifestieren. Ihr Name leitet sich entsprechend von „a“ (nicht) und dem lateinischem Namen „scorbutus“ für Skorbut ab. Da Ascorbinsäure leicht oxidierbar ist, wirkt sie als Redukton und wird als Antioxidans eingesetzt.
Die L-(+)-Ascorbinsäure und deren Derivate mit gleicher Wirkung werden unter der Bezeichnung Vitamin C zusammengefasst.[2] Der Sammelbegriff Vitamin C umfasst daher auch Stoffe, die im Körper zu L-(+)-Ascorbinsäure umgesetzt werden können, wie z. B. die Dehydroascorbinsäure (DHA).
Inhaltsverzeichnis
Geschichte
Skorbut war bereits im 2. Jahrtausend v. Chr. im Alten Ägypten als Krankheit bekannt. Auch der griechische Arzt Hippokrates und der römische Autor Plinius berichten darüber.
Bis ins 18. Jahrhundert war Skorbut die häufigste Todesursache auf Seereisen. Im Jahre 1747 untersuchte der englische Schiffsarzt James Lind diese Krankheit. Er nahm zwölf Seeleute, die unter der Skorbut litten und teilte sie in sechs Gruppen zu je zwei Personen. Jeder Gruppe gab er zusätzlich zu den üblichen Nahrungsrationen einen weiteren speziellen Nahrungmittelzusatz. Im Speziellen: Obstwein, Schwefelsäure, Essig, Gewürze und Kräuter, Seewasser, sowie Orangen und Zitronen. Er stellte fest, dass die Gruppe, welche die Zitrusfrüchte erhielt, eine rasche Besserung zeigte. 1757 veröffentlichte Lind dieses Resultat. Doch erst 1795 ließ die britische Marine die Nahrungsrationen auf See mit Zitronensaft ergänzen. Zusätzlich wurden auch Sauerkraut und Malz zur Skorbutprävention eingesetzt.
Lange Zeit wurde antizipiert, dass Skorbut die Folge einer speziellen (bakteriellen) Erkrankung, Vergiftung, mangelnde Hygiene oder Überarbeitung sei. Der Engländer George Budd schlug bereits 1842 vor, dass in der Nahrung spezielle, essentielle Faktoren enthalten sein müssen. Fehlen diese in der Nahrung, würden erkennbare Mangelerscheinungen auftreten. Im Jahr 1912 entdeckte der Biochemiker Casimir Funk nach Studien zu der Mangelerkrankung Beri-Beri, dass diese durch das Fehlen einer chemischen Substanz, Thiamin, verursacht wurde. Er prägte dafür das Kunstwort „Vitamin“, was die Zusammensetzung für ein vitales Amin darstellt (vit. Amin). Den damals noch unbekannten Faktor, der heutzutage als Vitamin C bekannt ist, nannte er Antiskorbut-Vitamin.
1921 gab der Biochemiker Sylvester Zilva einer Mischung von aus Zitronensaft isolierten Substanzen, die in der Lage war, Skorbut zu heilen, die Bezeichnung Vitamin C.[3] Interessanterweise gelang es bereits 1927 dem ungarischen Wissenschaftler Albert von Szent-Györgyi Nagyrapolt, Vitamin C aus der Nebenniere, Orangensaft bzw. Weißkohl zu isolieren. Die so isolierte Ascorbinsäure sandte er Zilva zu, der nach Analyse fälschlicherweise jene aber nicht als Vitamin C erkannte. Durch diesen Fehler verzögerte sich die Identifikation von Ascorbinsäure als Vitamin C um mehrere Jahre. In den 1920er Jahren verfehlten auch andere, wie z. B. der Wissenschaftler Karl Paul Link oder Oberst Edward B. Vedder, den Nachweis dafür, dass Ascorbinsäure Skorbut heilen kann und das postulierte Vitamin C ist.
Zwischen 1928 und 1934 gelang es dem ungarischen Wissenschaftler Szent-Györgyi, sowie Joseph L. Svirbely und unabhängig davon Charles Glen King mit seinen Mitarbeitern durch Kristallisationsversuche die für die Heilung der Skorbut verantwortliche Substanz zu isolieren. 1931 isolierten King und Svirebly kristallines Vitamin C aus Zitronensaft und erkannten, dass diese Skorbut heilen kann und physikalischen und chemischen Eigenschaften der damals noch kaum charakterisierten sogenannten Hexuronischen Säure[4], der heutigen Ascorbinsäure, teilte. Szent-Györgyi wollte diese Säure zunächst Ignose nennen (von ignosco), da sie trotz vieler Wissenslücken mit Hexosen verwandt war. Dieser Name wurde aber nicht akzeptiert. Da aber die Anzahl der Kohlenstoffatome (sechs C-Atome) bekannt war und die Substanz sich wie eine Säure verhält, wurde der Name Hexuronische Säure von Szent-Györgyi eingeführt. Svirebly wechselte bald als Mitarbeiter zu Szent-Györgyi, die bewiesen, dass die bisher isolierten Substanzen mit Skorbut heilenden Eigenschaften (Vitamin C) mit denen der Hexuronischen Säure übereinstimmten. Damit stellte Szent-Györgyi fest, dass diese das lang gesuchte Vitamin C ist.
Die Struktur dieser damals noch Hexuronischen Säure genannten Verbindung wurde von 1933 schließlich durch die Arbeiten von Walter Norman Haworth und dessen damaligen Assistenten Edmund Hirst aufgeklärt. Szent-Györgyi und Haworth änderten den Namen der Hexuronsichen Säure schließlich in L-Ascorbinsäure, der bis heute akzeptiert wird. 1934 gelang Haworth und Tadeus Reichstein erstmalig die Synthese künstlicher L-Ascorbinsäure aus Glucose.[5] Haworth erhielt 1937 für seine Forschungen am Vitamin C den Nobelpreis für Chemie, Szent-Györgyi den für Medizin. Seit 1967 wurde von Linus Pauling die Verwendung hoher Dosen von Ascorbinsäure (er selbst nahm 18 g pro Tag ein) als Vorbeugung gegen Erkältungen und Krebs propagiert, was jedoch umstritten ist (siehe unten).
Vorkommen
In der Nahrung kommt Vitamin C vor allem in Obst und Gemüse vor, sein Gehalt sinkt jedoch beim Kochen, Trocknen oder Einweichen sowie bei der Lagerhaltung. Zitrusfrüchte wie Orangen, Zitronen und Grapefruits enthalten – in reifem Zustand unmittelbar nach der Ernte – viel Vitamin C. Grünkohl hat den höchsten Vitamin-C-Gehalt aller Kohlarten (105–120 mg/100 g verzehrbare Substanz). Rotkraut, Weißkraut und Sauerkraut sind ebenfalls Vitamin-C-Lieferanten. Sauerkraut war lange Zeit in der Seefahrt von Bedeutung, da ein haltbares, an Vitamin C reiches Nahrungsmittel benötigt wurde. Die höchsten natürlichen Vitamin-C-Konzentrationen hat man in Camu-Camu und in der Acerolakirsche gefunden. In Kohlgemüse ist Ascorbinsäure in Form von Ascorbigen A und B gebunden. Wird das Gemüse gekocht, zerfallen die Moleküle in L-Ascorbinsäure und 3-Hydroxyindol, so dass es in gekochtem Zustand mehr Vitamin C enthalten kann als im rohen Zustand. Durch zu langes Kochen wird das Vitamin jedoch zerstört und gelangt verstärkt in das Kochwasser. Viele Gemüsearten enthalten Ascorbinsäure-Oxidase, die insbesondere durch Zerkleinern mit dem Vitamin in Berührung kommt und dieses oxidiert. Das führt z. B. bei Rohkost, die nicht sofort verzehrt wird, zu erheblichen Vitamin-C-Verlusten.
Hier der Vitamin-C-Gehalt einiger Früchte bzw. Gemüse je 100 g, geordnet nach absteigendem Vitamin-C-Gehalt:
- Camu-Camu 2000 mg
- Acerolakirsche 1300–1700 mg
- Hagebutte 1250 mg
- Sanddornbeere 200–800 mg
- Guave 300 mg
- Schwarze Johannisbeere 189 mg
- Petersilie 160 mg
- Grünkohl 105–150 mg
- Rosenkohl 90–150 mg
- Paprika 100 mg
- Ananas 20 mg
- Sauerkraut 20 mg
- Kartoffel 17 mg
- Avocado 13 mg
- Kulturapfel 12 mg
- Banane 10–12 mg
- Pfirsich 10 mg
- Zwiebel 7 mg
- Birne 5 mg
Die Angaben dienen nur der Orientierung, die tatsächlichen Werte hängen stark von der Sorte der Pflanze, der Bodenbeschaffenheit, dem Klima während des Wachstums, der Lagerdauer nach Ernte, den Lagerbedingungen, sowie der Zubereitung ab.
Herstellung und technische Verwendung
Synthese
Ascorbinsäure kann aus C5-Zuckern wie L-Xyloson, L-Lyxose, L-Xylose und L-Arabinose synthetisiert werden.
Für die großtechnische Synthese dagegen wird in chemischen Fabriken aus der Ausgangssubstanz D-Glucose über Sorbitol kristalline Ascorbinsäure, Natriumascorbat (E 301), Calciumascorbat (E 302) und Ascorbylmonophosphat hergestellt. Diese so genannte Reichstein-Synthese (1934) ist bis heute die Grundlage dieser industriellen, chemisch-mikrobiologischen Produktion.
Zur Unterscheidung von diesem synthetisch hergestellten Produkt wird ein mit Hilfe gentechnisch veränderter Mikroorganismen hergestelltes Vitamin C international mit GMO-Vitamin C (GMO, genetically manipulated organism: „genetisch veränderter Organismus“) bezeichnet. GMO-Ascorbinsäure ist preiswerter; nach diesem Verfahren wird weltweit der größere Teil hergestellt.
Auch im sogenannten Sonoyama-Verfahren wird Ascorbinsäure aus D-Glucose hergestellt.[6] Dabei wird dieses zunächst durch Erwinia herbicola zu 2,5-Dioxo-D-Gluconsäure oxidiert. Ein zweiter Stamm, Aureobacterium sp., reduziert das Produkt zu 2-Oxo-L-Gulonsäure, welches dann wie bei der Reichstein-Synthese zu L-Ascorbinsäure umgesetzt wird. Es wird versucht, E. herbicola-Stämme gentechnisch so zu verändern, dass diese aus Glucose in einem einstufigen mikrobiellen Verfahren 2-Oxo-L-Gulonsäure herstellen.[7]
Die Jahresproduktion für Ascorbinsäure liegt weltweit bei etwa 80.000 Tonnen (2006).[8] Diese Menge hat sich seit 1999 mehr als verdoppelt (1999: 35.000–40.000 t[9], 2004: >50.000 t[10]). Marktführer war lange Zeit die Schweizer Hoffmann-La Roche (30 % Weltumsatz) gefolgt vom BASF-NPEG Kartell (auch etwa 30 %) und der Firma Merck. 2002 hat Hoffmann-La Roche seine Vitaminsparte für 3,4 Milliarden Schweizer Franken (etwa 2,1 Milliarden Euro) an die holländische Koninklijke DSM verkauft. Ascorbinsäure wird zurzeit hauptsächlich in China produziert.
technische Verwendung
Ascorbinsäure findet hauptsächlich als Antioxidans Verwendung. Sie wird vielen Lebensmittelprodukten als Konservierungsmittel beziehungsweise Umrötungshilfsmittel unter der Nummer E 300 zugesetzt. Weitere E-Nummern von Ascorbinsäurederivaten sind E 301 (Natriumascorbat), E 302 (Calciumascorbat), E 304a (Ascorbylpalmitat) und E 304b (Ascorbylstearat). Der Ascorbinsäurezusatz zu Mehlen soll das Gashaltevermögen und das Volumen der Teige vergrößern. Dies lässt sich durch die Ausbildung zusätzlicher Disulfidbrücken zwischen den Kleber-Strängen des Teiges erklären. Auch im Pharma-Bereich dient Ascorbinsäure als Antioxidans zur Stabilisierung von Pharmaprodukten.
Wegen seiner reduzierenden Eigenschaft wird Ascorbinsäure auch vereinzelt als Entwicklungssubstanz in photographischen Entwicklern eingesetzt.
Zum Auflösen von Heroinbase vor der Injektion wird oft Ascorbinsäure mit dem Heroin aufgekocht.
Chemische Eigenschaften
Struktur
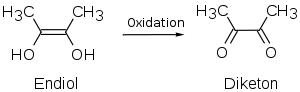
Ascorbinsäure enthält mehrere Strukturelemente, die zu ihrem chemischen Verhalten beitragen: eine Lactonstruktur, zwei enolische Hydroxylgruppen sowie eine sekundäre und eine primäre Alkoholgruppe. Der Lactonring ist nahezu planar.[11] Die Endiol-Struktur bedingt die reduzierenden (antioxidativen) Eigenschaften der Ascorbinsäure, da Endiole leicht zu Diketonen oxidiert werden können wie folgendes Beispiel zeigt:
Endiole mit benachbarter Carbonylgruppe nennt man daher auch Reduktone.
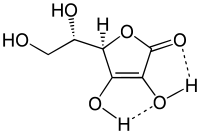
Ascorbinsäure bildet zwei intramolekulare Wasserstoffbrückenbindungen, die maßgeblich zur Stabilität und damit zu den chemischen Eigenschaften der Endiol-Struktur beitragen:
Acidität
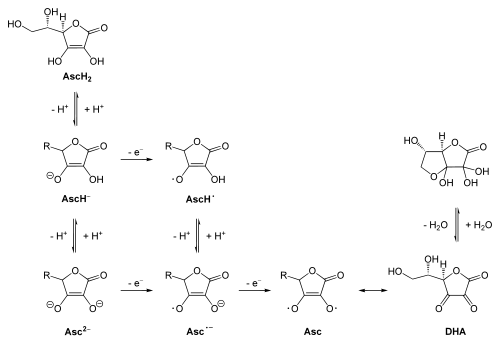
Obwohl Ascorbinsäure keine der „klassischen“, sauren funktionellen Gruppen (Carbonsäure, Sulfonsäure, Phosphonsäure, etc.) aufweist, ist sie beträchtlich sauer. Mit einem pKs-Wert von 4,25[11] ist sie sogar stärker sauer als Essigsäure (pKs = 4,8). Sie liegt damit unter physiologischen Bedingungen als Anion (AscH−) vor (vgl. Abbildung).
Dies ist zum Einen auf die Endiol-Struktur zurückzuführen. Enole sind bereits deutlich saurer als Alkohole. Zusätzlich wird die Azidität bei Ascorbinsäure durch die zweite enolische OH-Gruppe und durch die benachbarte Carbonylgruppe noch verstärkt. Zum Anderen wird das nach Abspaltung des Protons entstehende Enolat-Anion mittels Keto-Enol-Tautomerie stabilisiert. Die dann bestehende negative Ladung am Sauerstoff wird dabei sowohl über die Doppelbindung zwischen den beiden Kohlenstoffatomen, als auch über die Carbonylfunktion delokalisiert, also verteilt, und somit stabilisiert.
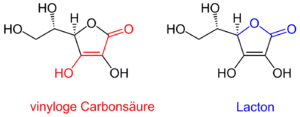
Strukturell könnte man diese Gruppierung auch als vinyloge Carbonsäure auffassen, d. h. als eine Carbonsäure-Funktion mit „eingeschobener“ C-C-Doppelbindung zwischen Carbonylgruppe und OH-Gruppe.
Die andere enolische OH-Gruppe (in den Strukturformeln rechts unten) hat nur schwach saure Eigenschaften (pKs = 11,79[11]), da hier das Anion weniger mesomere Grenzstrukturen zur Stabilisierung ausbilden kann. Nach Abgabe beider Protonen entsteht aus Ascorbinsäure ein Dianion (Asc2−) (vgl. auch Abbildung).
Die intermediäre Form, die durch Abgabe eines Elektrons und eines Protons entsteht (AscH.) ist eine sehr starke Säure (pKs = −0,45).[11] Sie hat aber wegen ihrer Kurzlebigkeit im Metabolismus keine Bedeutung.
Reduktionsmittel
Ascorbinsäure ist in wässrigen Lösungen ein starkes Reduktionsmittel. Hiebei kann es über Zwischenstufen zu Dehydroascorbinsäure (DHA) oxidiert werden (vgl. obere Abbildung). Dieser Prozess ist auch reversibel, so können bespielsweise Cystein, Natriumdithionat bzw. andere Thiole DHA zurück zu Ascorbinsäure reduzieren.
In der Reduktons-/Oxidationswirkung liegt die wichtigste Eigenschaft von Vitamin C in biologischen Systemen.
Säurerest
Das Säurerest-Ion der Ascorbinsäure nennt sich Ascorbat[12]. Es entsteht durch Übertragung eines Wasserstoffions (H+, Proton) auf ein protonierbares Lösungsmittel, etwa Wasser. Deswegen lautet seine Summenformel C6H7O6−. Die Reaktion ist eine Gleichgewichtsreaktion:
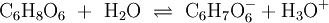 .
.- Ascorbinsäure reagiert mit Wasser zu Ascorbat und einem Oxonium-Ion.
Stereochemie
Ascorbinsäure hat zwei asymmetrische Kohlenstoffatome (C4 und C5) und existiert damit in vier verschiedenen stereoisomeren Formen, die optische Aktivität aufweisen:
- L-Ascorbinsäure (R,S) (1a im Bild rechts)
- D-Ascorbinsäure (S,R) (1b)
- L-Isoascorbinsäure (R,R) (2a) PubChem 6981
- D-Isoascorbinsäure (S,S) (2b)
Die Moleküle L- und D-Ascorbinsäure verhalten sich wie Bild und Spiegelbild zueinander, sie sind Enantiomere, ebenso die L- und die D-Isoascorbinsäure.
L-Ascorbinsäure und D-Isoascorbinsäure sowie D-Ascorbinsäure und L-Isoascorbinsäure sind Epimere, sie unterscheiden sich jeweils in der Konfiguration nur eines C-Atoms. Trotz dieser geringen Unterschiede sind die Stereoisomere der L-Ascorbinsäure im Körper fast alle inaktiv, da die am Stoffwechsel beteiligten Enzyme spezifisch L-Ascorbinsäure erkennen. Lediglich die D-Isoascorbinsäure (E 315) weist eine geringe Wirkung auf.
Nachweis
Um Ascorbinsäure quantitativ nachzuweisen, gibt es zahlreiche colorimetrische Methoden.[11]Normalerweise verwendet man 2,4-Dinitrophenylhydrazin. Ascorbinsäure reagiert mit diesem zu einem Hydrazon, dessen Absorption man messen kann. Darüber hinaus kann 2,2′-Bipyridin zum colorimetrischen Nachweis dienen. Hierbei macht man sich die Reduktionskraft der Ascorbinsäure zunutze, die Fe(III) zu Fe(II) reduziert. Fe(II) bildet dann mit 2,2′-Bipyridin einen farbigen Komplex. Es sind auch einige fluorometrische Nachweismethoden bekannt. Ascorbinsäure lässt sich auch durch Titration mit Tillmans' Reagenz (2,6-Dichlorphenolindophenol, abgekürzt DCPIP) nachweisen, bei der das Reagenz durch die Ascorbinsäure zu einer Leukoverbindung reduziert wird. Dabei ist ein Farbumschlag von tiefblau zu farblos zu beobachten. Diese Methode eignet sich für eine schnelle Bestimmung, die aber an der Genauigkeit oben genannter Wege nicht heranreicht.[11]
Dehydroascorbinsäure
L-Dehydroascorbinsäure (englisch dehydro ascorbic acid, DHA) entsteht durch Oxidation von Ascorbinsäure. Im menschlichen Metabolismus kann sie zu L-Ascorbinsäure reduziert werden und damit Vitamin-C regenerieren. Dehydroascorbinsäure liegt in wässrigen Lösungen nahezu vollständig als Monohydrat (mono-DHA·H2O) vor. Dabei bildet es einen Bizyklus, was man durch Kern(spin)resonanzspektroskopie nachgewiesen hat. Möglicherweise kann es noch ein zweites Molekül Wasser aufnehmen, um dann ein Dihydrat auszubilden[13]. Auch Semi-Dehydroascorbinsäure sowie oxidierte Formen veresterter Ascorbinsäuren werden zur Gruppe der Dehydroascorbinsäure gezählt.
Generell wird Vitamin-C in Form von DHA durch Glucosetransporter, hauptsächlich GLUT-1, in die Mitochondrien der Zellen transportiert, da nur sehr wenige Zellen über spezifische Vitamin C-Transporter verfügen.[14] Hierbei sind die meisten dieser Transporter Natriumionen-abhängig. Insbesondere das Gehirn ist auf eine Versorgung von Ascorbinsäure angewiesen, das Vitamin kann jedoch nicht die Blut-Hirnschranke passieren.[15] Dieses Problem wird dadurch umgangen, dass Dehydroascorbinsäure auch durch Glucosetransporter, z. B. GLUT1, durch die Schranke transportiert und in den Gehirnzellen zu Ascorbinsäure reduziert wird.
Es wird davon ausgegangen, dass Ascorbinsäure in Form von DHA intrazellulär transportiert wird. Hierbei soll extrazelluläre Ascorbinsäure zu DHA oxidiert, in die Zelle aufgenommen und dann wieder reduziert werden, da Ascorbinsäure selbst die Zelle nicht verlassen kann.[11]
DHA ist instabiler als L-Ascorbinsäure. Je nach Reaktionsbedingungen (pH-Wert, An- bzw. Abwesenheit von Oxdiationsmitteln wie Glutathion) kann es entweder wieder zurück in Ascorbinsäure umgewandelt werden, oder zu Diketogulonsäure (DKG) irreversibel hydrolysieren.[16][17]
Physiologische Bedeutung
Vitamin C ist ein Radikalfänger und hat eine antioxidative Wirkung (es wirkt also als Reduktionsmittel).
Weiterhin stellt Vitamin C ein wichtiges Coenzym für die Prolyl-Hydroxylase dar. Dieses Enzym wird bei der Biosynthese des Proteins (Eiweißes) Kollagen benötigt. Es wandelt integrierte Prolinreste in 4-Hydroxyprolyl-Seitenketten unter Verbrauch von molekularem Sauerstoff um. Hydroxyprolin ist für den stabilen Kollagenaufbau unerlässlich.
Ebenfalls innerhalb der Biosynthese von Kollagen, aber auch weiterer Proteine, findet mithilfe von Ascorbinsäure und des Enzyms Lysylhydroxylase die Hydroxylierung von L-Lysin zum Hydroxylysin statt. Im Kollagen erfüllt dieses eine Funktion in der kovalenten Quervernetzung benachbarter Moleküle. Darüber hinaus kann Hydroxylysin im Kollagen und weiteren Proteinen glykosyliert werden, was zur Bildung von Glykoproteinen führt.
Mangel an Vitamin C führt zu einer verminderten Aktivität der Prolyl-Hydroxylierung und der Lysyl-Hydroxylierung und damit zur Instabilität von Kollagen (Ehlers-Danlos-Syndrom). Da Kollagen in praktisch allen Organen und Geweben des menschlichen und tierischen Organismus vorkommt vor allem im Bindegewebe, wird bei Mangel von Vitamin C Skorbut ausgelöst.
Auch bei der Hydroxylierung von Steroiden ist Vitamin C ein wichtiger Cofaktor. Darüber hinaus spielt es eine wichtige Rolle beim Aufbau von Aminosäuren wie beispielswiese dem L-Tyrosin. Auch bei der Umwandlung von Dopamin zu Noradrenalin, im Cholesterin-Stoffwechsel und bei der Carnitinbiosynthese wird Ascorbinsäure benötigt.
Durch seine antioxidative Wirkung schützt es andere wichtige Metaboliten und das Erbgut vor der Oxidation bzw. dem Angriff durch freie Radikale.
Mit Niacin und Vitamin B6 steuert Vitamin C die Produktion von L-Carnitin, das für die Fettverbrennung in der Muskulatur benötigt wird. Weiterhin begünstigt es die Eisenresorption im Dünndarm.
Bedarf
In weiten Teilen der Welt ist die Versorgung mit Vitamin C relativ gut, der Tagesbedarf eines Erwachsenen beträgt laut Empfehlung der Deutschen Gesellschaft für Ernährung 100 mg. Die Meinungen hierüber gehen jedoch weit auseinander; die Empfehlungen anderer Gruppierungen liegen zwischen einem Bruchteil (z. B. der Hälfte) und einem Vielfachen (z. B. „so viel wie möglich“) dieses Wertes. Fest steht, dass Mengen bis zu 5000 mg kurzzeitig als unbedenklich gelten. Überschüssige Mengen werden vom Körper über den Urin ausgeschieden, da Vitamin C gut wasserlöslich ist (siehe auch Hypervitaminosen).
Bei einer ausgewogenen Mischkost kann in Deutschland davon ausgegangen werden, dass dem Körper alle lebensnotwendigen Vitamine, und daher auch Vitamin C, in ausreichendem Maße zugeführt werden. Die Versorgung mit Vitamin C ist in Deutschland knapp über der DGE-Empfehlung von 100 mg pro Tag. Daher sind Vitaminpräparate für einen gesunden Menschen, der sich abwechslungsreich und vollwertig ernährt, überflüssig. Raucher brauchen auf Grund der erhöhten Belastung mit freien Radikalen etwa 40 % mehr Vitamin C – laut DGE 150 mg/Tag. Die Empfehlung für Schwangere und Stillende liegt bei 110 bzw. 150 mg täglich. Ursache für eine unzureichende Zufuhr ist meistens eine einseitige Ernährung. Dies betrifft vor allem ältere Menschen, die nicht täglich frisches Obst und Gemüse verzehren.
Untersuchungen mit 14C-markiertem Vitamin C zeigen, dass der tägliche Ascorbatumsatz unabhängig von der Vitamin-C-Zufuhr nur etwa 20 mg beträgt. Somit genügen bereits knapp 20 mg täglich, um Skorbut zu vermeiden.
Für Vergleichszwecke interessant ist, dass für Meerschweinchen eine Tagesdosis von 10–30 mg empfohlen wird (bei einem Gewicht von ca. 0,8–1,5 kg), wobei es diese wie Menschen nicht selbst über die Leber produzieren können.
Mangelerscheinungen (Hypovitaminose)
Szent-Györgyi identifizierte 1933 das Vitamin C als wirksame Substanz gegen Skorbut.
Nur wenige Wirbeltiere, darunter Primaten (wie der Mensch), Meerschweinchen, einige Vögel und Schlangen, sind nicht zur Biosynthese von Ascorbinsäure aus Glucuronsäure befähigt, da ihnen die L-Gluconolacton-Oxidase fehlt. Für diese Lebewesen ist Ascorbinsäure somit essenziell. Darum muss der Bedarf über die Nahrung (bzw. mit Nahrungsmitteln) gedeckt werden. Mangelerscheinungen führen langfristig zu Skorbut sowie zur Schwächung des Bindegewebes, da Ascorbinsäure zur Collagen-Synthese benötigt wird (siehe oben). Bei Schlangen kommt es dabei bereits durch normale Berührung zu Hautrissen.
Überdosierung (Hypervitaminose)
Für Vitamin C ist die Hypervitaminose, wie sie beispielsweise bei Vitamin A vorkommen kann, sehr selten, da der Körper einen Überschuss an Ascorbinsäure wieder über die Nieren ausscheidet.
In einer vom National Institutes of Health (NIH) durchgeführtem Studie wurden sieben Freiwilligen zunächst mit einer ascorbinsäurearmen Diät ernährt und so ihre körpereigenen Vorräte an Vitamin C aufgebraucht. Als diese danach wieder mit Vitamin C versorgt wurden, begann die renale (über die Niere) Ausscheidung an unverändertem Vitamin C ab etwa 100 mg/Tag. Die Zufuhr über 400 mg/Tag wurde – soweit überhaupt im Darm aufgenommen (die Resorption von Megadosen senkt die Resorptionsquote deutlich) – praktisch vollständig renal ausgeschieden. Ab etwa 1 g pro Tag steigen die Oxalat- und sekundär auch die Harnsäure-Konzentrationen im Blutplasma.[18] Da ein Teil der Ascorbinsäure im Stoffwechsel zu Oxalsäure umgesetzt wird, besteht bei entsprechend disponierten Menschen ein erhöhtes Risiko für Calciumoxalat-Nierensteine (CaC2O4). Schon bei normaler Zufuhr stammen etwa 30 bis 50 % des Plasmaoxalats aus dem Vitamin-C-Abbau.
Hohe orale Einzeldosen können einen vorwiegend osmotisch bedingten Durchfall auslösen. Die jeweilige Dosis variiert von Person zu Person, wird aber von Robert Cathcart mit ca. 5–15 g (1–3 gehäufte Teelöffel) für eine gesunde Person angegeben.[19] Zu erwähnen ist allerdings auch, dass diese Toleranzgrenze bei Individuen, die an schweren Erkrankungen leiden, bis auf über 200 g ansteigen kann.
Bei Menschen mit Glucose-6-Phosphatdehydrogenase-Mangel (G6PD-Mangel, Favismus), einer insbesondere in Afrika sehr weit verbreiteten, erblichen Krankheit, können intravenöse Vitamin-C-Dosen, ca. 30–100 g pro Infusion, zur Hämolyse führen.[20] Allerdings ist dieses Problem noch nicht aufgetreten.
Häufig wird Vitamin C, besonders wenn auf nüchternen Magen konsumiert, mit Indigestion durch Übersäuerung des Magens in Verbindung gebracht. Dies kann unter anderem vermieden werden indem Vitamin C nicht als Ascorbinsäure, sondern als Ascorbat (Salz der Ascorbinsäure, z. B. Natrium-Ascorbat) aufgenommen wird. Dies kann zum Beispiel durch die Zugabe von Backpulver (NaHCO3) erreicht werden. Studien haben allerdings gezeigt, dass die Resorption von Vitamin C erhöht wird, wenn es zu Fruchtsäften wie z. B. Orangensaft gemischt wird.
Bei der Ratte liegt der LD50-Wert (die Dosis, bei der die Hälfte der Versuchstiere sterben) für Vitamin C bei 11,9 g pro Kilogramm Körpergewicht, bei der Maus bei 3,37 g (jeweils oral).[21] Das entspricht bei einem 70 kg schweren Menschen einer Dosis von 833 g.
Therapeutisch und prophylaktisch eingesetzt wird die Überdosierung von Vitamin C z. B. bei Harnwegsinfektionen. Durch die renale Ausscheidung der Ascorbinsäure wird der Urin sauer. In diesem sauren Milieu können die Erreger deutlich schlechter gedeihen.[22]
Stoffwechsel im Detail
Ascorbinsäure kann sowohl mit der Nahrung aufgenommen, als auch vom Stoffwechsel der meisten Lebewesen selbst synthetisiert werden. Ausnahmen bei der Synthese sind alle Primaten, Meerschweinchen und auch Flughunde.
Aufnahme mit der Nahrung
Der Transportweg von Vitamin C erfolgt über Enterozytzellen des Darmes. Wie es von dort in die Blutstrom gelangt, ist noch nicht vollständig verstanden.[23] Jedoch ist der Transport von Ascorbat bzw. Dehydroascorbat (DHA) vom Blut in alle anderen Zellen besser verstanden.
Die Aufnahme von Dehydroascobat (DHA, vergleiche Abschnitt oben) in das Zellinnere (Zytosol) menschlicher Zellen findet mithilfe dreier Glucosetransporter statt, und zwar GLUT-1, GLUT-3 und GLUT-4. DHA konkurriert dabei mit Glucose, so dass ein Übermaß an Glucose effektiv die Aufnahme von DHA verhindern kann. Was Ascorbat anbetrifft, wird es zusammen mit je zwei Natriumionen mittels der Transportproteine SVCT1 und SVCT2 ins Zellinnere geschleust.[24][25][26]
Biosynthese
Ascorbinsäure wird von Bakterien, Pflanzen und Wirbeltieren mithilfe jeweils verschiedener Enzyme produziert. Ausgangssubstanzen sind hauptsächlich D-Glucose bzw. D-Galaktose.
Bei Pflanzen können neben D-Glucose und D-Galaktose uach D-Glucuronlacton, D-Galakturonat bzw. dessen Methylester die Biosynthese einleiten.
Biosynthese in Wirbeltieren
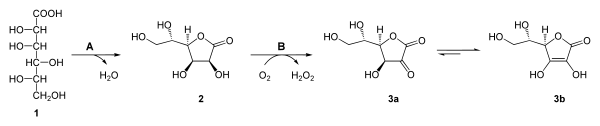
Bei Ratten wurde die Biosynthese am besten untersucht.[11] Die Bildung der Ascorbinsäure beginnt mit der Oxidation von UDP-D-Glucose zu UDP-D-Glucuronsäure durch das Enzym UDP-Glucose-Dehydrogenase (EC 1.1.1.22). Oxidationsmittel ist dabei das NAD+.
Nach hydrolytischer Abspaltung des UDP bildet sich die D-Glucuronsäure, die durch regioselektive Reduktion durch die Glucuronsäure-Reduktase und NADPH+H+ in L-Gulonsäure (EC 1.1.1.19) (vgl. 1 in der Abbildung) überführt wird. Die Lactonisierung (Ringbildung) zum L-Gulofuranolacton (L-Gulano-1,4-lacton) (2) katalysiert eine Glucono-Lactonase (EC 3.1.1.17). Ihr folgt die selektive Oxidation mit Sauerstoff durch L-Gulono-γ-lacton-Oxidase (EC 1.1.3.8) zu 2-Keto-L-Gulonlacton (3a). [27]. Diese tautormerisiert spontan zur Ascorbinsäure (3b).
Ausnahmen
Primaten, Meerschweinchen sowie Flughunden fehlt das Säugetierenzym L-Gulono-γ-lacton-Oxidase aufgrund eines genetischen Defekts, so dass sie deshalb Ascorbinsäure nicht synthetisieren können.[28] Man geht davon aus, dass die genetische Mutation bei Primaten vor etwa 65 Millionen Jahren auftrat.[28] Da jene Primaten in einer Gegend angesiedelt waren, die ganzjährig reich an Vitamin-C-haltigen Früchten war, hatte dieser an sich letale Defekt keine so negativen Auswirkungen, dass zu viele Exemplare der betroffenen Spezies vor Erreichen des fortpflanzungsfähigen Alters daran gestorben wären.
Funktion
Die wichtigste Funktion der Ascorbinsäure im menschlichen Organismus beruht auf ihrer Eigenschaft als Reduktionsmittel. Sie ist also in der Lage Elektronen auf andere Moleküle zu übertragen.
Man kann zwei grundsätzliche Aufgaben unterscheiden:
Ascorbinsäure als Radikalfänger (Scavenger)
Ascorbinsäure dient im tierischen Organismus als Radikalfänger, da es in der Lage ist eben solche auf andere Moleküle zu übertragen. Die Grafik zeigt nicht den tatsächlichen Reaktionsmechanismus, sondern schematisch die Fähigkeit der Ascorbinsäure, unter Reaktion zur Dehydroascorbinsäure zwei Radikale freisetzen zu können (vgl. obere Abbildung).
Bei der Verstoffwechslung des Sauerstoffs in der Zelle kann es zur Bildung des Hyperoxideradikals O2•− kommen, wenn der molekulare Sauerstoff O2 bei der Endreaktion der Atmungskette statt vier nur ein Elektron erhalten hat. Das Hyperoxideradikal ist aufgrund dieses Elektronenmangels extrem reaktiv und in der Lage molekulare Zellstrukturen zu schädigen. Die Reaktion mit Ascorbinsäure überführt dieses in Wasserstoffperoxid:[29]
Das Wasserstoffperoxid wird von dem Enzym Katalase abgebaut.[29]
Ascorbinsäure als Cofaktor in Redoxreaktionen
Sowohl Ascorbinsäure (als auch dessen reduzierte Form (DHA)) sind Cofaktoren für viele biochemische Reaktionen. Hierbei stellt Ascorbinsäure Elektronen für Kupfer(I)-abhängige Monooxygenasen bzw. Eisen(III)-abhängige Dioxygenasen bereit. Interessanterweise können in vitro auch andere Redoxfaktoren diese enzymatische Reaktionen katalysieren.
Von Bedeutung ist diese Redoxeigenschaft der Ascorbinsäure beispielsweise bei der Synthese von Collagen im menschlichen Stoffwechsel. Zur Darstellung dieses Strukturproteins muss die Aminosäure L-Prolin zu ihrer oxidierten Form, Hydroxyprolin, umgewandelt werden. Ascorbinsäure dient dazu, das in dieser Reaktion genutzte Oxidationsmittel Fe(II), zu regenerieren. Besteht ein Mangel an Vitamin C, kann die Bildung des Hydroxyprolins bei der Collagensynthese nur begrenzt erfolgen, so dass die typischen Symptome der Skorbut wie Zahnfleischbluten, Zahnausfall und Hautschäden auftreten.
Recycling der Oxidationsprodukte
Die nach Oxidation entstehenden Produkte Semidehydroascorbinsäure und Dehydroascorbinsäure werden enzymatisch wieder zu Ascorbinsäure reduziert. Die Enzyme Cytochrom b5 Reduktase und Thioredoxinreduktase katalysieren die Umwandlung von Semidehydroascorbinsäure zu Ascorbinsäure im Cytosol, unter Verbrauch von NADH bzw. NADPH. Außerdem kann eine Reduktion über elektronentransferierende Membranproteine stattfinden. Dehydroascorbinsäure wird sowohl spontan mittels Glutathion oder NADPH reduziert, als auch enzymatisch über die Glutathiontransferase Omega.[30][31]
Abbau
Der Abbau von Dehydroascorbinsäure wird bei Säugetieren durch Hydrolyse zur physiologisch inaktiven 2,3-Diketogulonsäure eingeleitet. Diese wird entweder zu Oxalat und L-threonischer Säure gespalten oder zu Kohlenstoffdioxid, Xylose, Xylulose decarboxyliert. [11] Im Unterschied dazu haben Bakterien wie E. coli enzymatische Stoffwechselwege für den Abbau von Ascorbinsäure, und wahrscheinlich auch für Dehydroascorbinsäure.[30]
Literatur
- Lester Packer und Jürgen Fuchs: Vitamin C in Health and Disease. Marcel Dekker Inc illustrated edition 1997; ISBN 0-8247-9313-7
- Hans K. Biesalski, Josef Köhrle, Klaus Schümann: Vitamine, Spurenelemente und Mineralstoffe. Prävention und Therapie mit Mikronährstoffen., Thieme, Stuttgart 2002, ISBN 3-13-129371-3.
- Linus Pauling: Linus Paulings Vitamin-Programm. Plädoyer für ein gesundes Leben. Bertelsmann, 1990, ISBN 3-570-02671-X
- Linus Pauling: Vitamin C und der Schnupfen. Übers. v. Friedrich G. Helfferich. Verlag Chemie, Weinheim 1972. ISBN 3-527-25458-7
- Naidu, K.A. (2003): Vitamin C in human health and disease is still a mystery? An overview. In: Nutr. J. 2:7. PMID 14498993 doi:10.1186/1475-2891-2-7 PDF
Weblinks
- Ascorbat- und Alderatstoffwechsel bei Kegg-Enzyme
- Vitaminversorgung in Deutschland (DGE Angaben)
- WDR-Sendung Quarks & Co.: Vitamin C auf der Spur
- Jassal/reactome.org: Vitamin C (ascorbate) metabolism (engl.)
Einzelnachweise
- ↑ a b c d Eintrag zu Ascorbinsäure in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 18. Juli 2008 (JavaScript erforderlich)
- ↑ Weber, P.: Vitamin C. ; Vitamine, Spurenelemente und Mineralstoffe, 2002, 57–69.
- ↑ Harden, A. und Zilva, SS. (1918): The Antiscorbutic Factor in Lemon Juice. In: The Biochemical Journal, 12, 259–269; PDF (freier Volltextzugriff, engl.)
- ↑ Svirbely, JL. und Szent-Gyorgyi, A. (1933): The Chemical Nature Of Vitamin C. In: The Biochemical Journal 27; 279–285; PDF (freier Volltextzugriff, engl.)
- ↑ GB-Patent Nr.443901 Improvements in or relating to the manufacture of ascorbic acid and its analogues
- ↑ Sonoyama, T. et al. (1982): Production of 2-Keto-L-Gulonic Acid from D-Glucose by Two-Stage Fermentation. In: Appl Environ Microbiol. 43(5); 1064–1069; PMID 16346005; PDF (freier Volltextzugriff, engl.)
- ↑ Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme Verlag Stuttgart 2008; ISBN 978-3-13-144861-3; S. 569
- ↑ GdCh: Weiße Biotechnologie: Status quo und Zukunft. in Nachrichten aus der Chemie, Dezember 2006.
- ↑ M. S. Hähnlein: Entwicklung und Charakterisierung von Edelmetallträgerkatalysatoren und Edelmetallnanosolen zur katalytischen Nitrat- und Nitritreduktion sowie zur Sorboseoxidation. Dissertation Technische Universität Braunschweig, 1999.
- ↑ J. Emsley, A. Schleitzer (Übers.): Fritten, Fett und Faltencreme: Noch mehr Chemie im Alltag. Wiley-VCH, 2004, ISBN 978-3-52731147-7.
- ↑ a b c d e f g h i Tsao, CS.: An overview of ascorbic acid chemistry and biochemistry. In: Lester Packer und Jürgen Fuchs. a. a. O.; Seiten 25–58
- ↑ Säure-Base-Reaktionen, Seite 4
- ↑ Bors, W. und Buettner, GR.: The vitamin C radical and its reactions. In: Lester Packer und Jürgen Fuchs. a. a. O.; Seite 76
- ↑ Sagun KC et al.:„Vitamin C enters mitochondria via facilitative glucose transporter 1 (Glut1) and confers mitochondrial protection against oxidative injury“, FASEB Journal (2005), 19 (12): 1657–1667. PMID 16195374; PDF (freier Volltextzugriff).
- ↑ Huang J et al.: „Dehydroascorbic acid, a blood-brain barrier transportable form of vitamin C, mediates potent cerebroprotection in experimental stroke“; PNAS (2001), 98 (20): S. 11720–11724; PMID 11573006; PDF (freier Volltextzugriff).
- ↑ Nishikawa, Y. und Kurata, T. (2000): Interconversion between dehydro-L-ascorbic acid and L-ascorbic acid. In: Biosci Biotechnol Biochem. 64(3); 476–483; PMID 10803943; PDF (freier Volltextzugriff, engl.)
- ↑ Nishikawa, Y. et al. (2001): Identification of 3,4-dihydroxy-2-oxo-butanal (L-threosone) as an intermediate compound in oxidative degradation of dehydro-L-ascorbic acid and 2,3-diketo-L-gulonic acid in a deuterium oxide phosphate buffer. Biosci Biotechnol Biochem. 65(8); 1707–1712; PMID 11577707; PDF (freier Volltextzugrff).
- ↑ M. Levine et al. (1996): „Vitamin C pharmacokinetics in healthy volunteers: evidence for a recommended dietary allowance“, Proc. Nat. Acad. Sci., Vol. 93, S. 3704–3709. Volltext.
- ↑ Vitamin C, Titrating To Bowel Tolerance, Anascorbemia, and Acute Induced Scurvy. Orthomed. Abgerufen am 16. März 2007. (englisch)
- ↑ Intravenous Ascorbate as a Chemotherapeutic and Biologic Response Modifying Agent. The Center For The Improvement Of Human Functioning International. Abgerufen am 16. März 2007. (englisch)
- ↑ Safety (MSDS) data for ascorbic acid. Oxford University, 9. Oktober 2005. Abgerufen am 16. März 2007. (englisch)
- ↑ Harnwegsinfektionen. Dr. med. Heribert Schorn, 11. Juli 2008. Abgerufen am 15. Juli 2008. (deutsch)
- ↑ Wilson, JX. (2002): The physiological role of dehydroascorbic acid. In: FEBS Lett. 527(1-3); 5–9; PMID 12220624; PDF (freier Volltextzugriff, engl.)
- ↑ Rumsey SC, Kwon O, Xu GW, Burant CF, Simpson I, Levine M: Glucose transporter isoforms GLUT1 and GLUT3 transport dehydroascorbic acid. In: J. Biol. Chem.. 272, Nr. 30, July 1997, S. 18982–9. PMID 9228080
- ↑ Liang WJ, Johnson D, Jarvis SM: Vitamin C transport systems of mammalian cells. In: Mol. Membr. Biol.. 18, Nr. 1, 2001, S. 87–95. PMID 11396616
- ↑ Wang H, Dutta B, Huang W, et al: Human Na(+)-dependent vitamin C transporter 1 (hSVCT1): primary structure, functional characteristics and evidence for a non-functional splice variant. In: Biochim. Biophys. Acta. 1461, Nr. 1, November 1999, S. 1–9. PMID 10556483
- ↑ John M. C. Gutteridge, Naoyuki Taniguchi: Experimental Protocols for Reactive Oxygen and Nitrogen Species, 2000, Oxford University Press, ISBN 0-19-850668-6.
- ↑ a b The Natural History of Ascorbic Acid in the Evolution of Mammals and Primates, Irwin Stone, 1972.
- ↑ a b Becher G; Winsel K: Short scientific report. Vitamin C lessens superoxide anion(O2)-induced bronchial constriction; Zeitschrift fur Erkrankungen der Atmungsorgane; 1989, 173, 100–104.
- ↑ a b Linster, CL. Van Schaftingen, E: Vitamin C. Biosynthesis, recycling and degradation in mammals. In: FEBS J.. 274, Nr. 1, January 2007, S. 1–22. doi:10.1111/j.1742-4658.2006.05607.x. PMID 17222174
- ↑ D'Eustachio/reactome.org: Reduction of dehydroascorbate to ascorbate
Wikimedia Foundation.