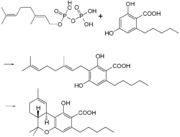
- Tetrahydrocannabinolsäure
-
Strukturformel 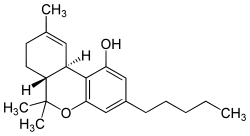
Allgemeines Name Tetrahydrocannabinol Andere Namen - (−)-Δ9-trans-Tetrahydrocannabinol
- (6aR,10aR)-6,6,9-Trimethyl- 3-pentyl-6a,7,8,10a-tetrahydro- 6H-benzo[c]chromen-1-ol
Summenformel C21H30O2 CAS-Nummer 1972-08-3 PubChem 16078 ATC-Code A04AD10
DrugBank APRD00571 Kurzbeschreibung viskoses Öl Arzneistoffangaben Wirkstoffklasse Fertigpräparate Marinol® (CDN), (USA)
Verschreibungspflichtig: Ja, Teilweise BtMG Eigenschaften Molare Masse 314,47 g·mol−1 Aggregatzustand flüssig
Siedepunkt 180 °C
Löslichkeit wenig löslich in Wasser (2,8 g·l−1 bei 23 °C) [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [2]
Xn
Gesundheits-
schädlichR- und S-Sätze R: 20/22 S: 51 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 482 mg/kg (Maus, peroral) [1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Δ9-Tetrahydrocannabinol [ˌtetraˌhydroˌkanabiˈnoːl] (Delta-9-THC, Δ9-THC, THC) gehört zu den psychoaktiven Cannabinoiden und ist der Hauptwirkstoff der Hanfpflanze (Cannabis sativa). Tetrahydrocannabinol unterliegt den Bestimmungen des Betäubungsmittelgesetzes.
Inhaltsverzeichnis
Chemie
Tetrahydrocannabinol kommt ausschließlich im Hanf (Cannabis sativa) vor. Es wurde erstmals 1964 von Yehiel Gaoni und Raphael Mechoulam am Weizmann-Institut für Wissenschaften in Israel isoliert.[3] Besonders reich an THC sind die unbefruchteten weiblichen Blütenstände (etwa 6 bis 20 %), der THC-Gehalt der übrigen Pflanzenteile ist weit geringer (knapp 1 %). In den Samen der Pflanze ist gar kein THC enthalten. Die Blätter nahe der Blüte enthalten ca. 5–6 % THC. Männliche Pflanzen haben im Unterschied zu weiblichen einen weit geringeren THC-Gehalt.
Biosynthese
Tetrahydrocannabinol liegt in der Cannabis-Pflanze überwiegend als THC-Säure vor. Durch enzymatische Kondensation aus den beiden Prekursoren Geranylpyrophosphat und Olivetolsäure wird Cannabigerolsäure gebildet, die anschließend enzymatisch in Tetrahydrocannabinolsäure umgelagert wird. Durch Wärme und UV-Strahlung decarboxyliert die Säure zum THC.
Extraktion
THC ist sehr lipophil. Es kann per Extraktion aus THC-haltigem Pflanzenmaterial isoliert werden, wozu unpolare und schwachpolare Lösungsmittel wie n-Alkane, Aceton, Isopropylalkohol oder Ethanol geeignet sind. Nach dem Abdampfen des Lösungsmittels bleibt ein harziger, ölartiger Extrakt zurück. Die Zusammensetzung des Extrakts ist abhängig von der Wahl des Lösungsmittels. Bei geeigneten Bedingungen können sehr hohe THC-Konzentration erreicht werden. Dieser Extrakt wird auch als Haschischöl bezeichnet.
Mit n-Butan (Feuerzeuggas) lassen sich lipophile Inhaltsstoffe bei sehr tiefen Temperaturen aus dem Pflanzenmaterial extrahieren; diese Methode bringt allerdings hohe Brand- und Explosionsgefahr mit sich. Butan verdampft bereits bei Zimmertemperatur. Der so erhaltene Extrakt hat ein Aussehen ähnlich wie Bernstein, bei Zimmertemperatur ist es dickflüssig und zieht Fäden wie Kunstharz. Wenn man es abkühlt, erstarrt es relativ schnell.
Neben THC enthält der Extrakt weitere Cannabinoide; bei Verwendung polarerer Extraktionsmittel wie Ethanol können entsprechend polarere Stoffe enthalten sein, wie Chlorophyll, Alkaloide (Trigonellin, Hordenin), Aminosäuren, Aminozucker[4], evt. auch ungelöste feine Teile des Ausgangsmaterials. Durch geeignete Verfahren kann der Extrakt noch weiter gereinigt werden.
Konsumformen
Der Konsum kann auf unterschiedliche Art erfolgen. Die üblichste Konsumform ist das Rauchen von Haschisch oder Marihuana pur oder gemischt mit Tabak. Häufig wird THC-haltiges Material auch mit Hilfe speziellen Rauchzubehörs wie Bongs und Pfeifen geraucht oder mit dem Vaporizer verdampft und inhaliert.
Daneben wird THC auch in Speisen und Getränken verarbeitet. Da THC lipophil ist, kann es in fettreichen Nahrungsmitteln wie Milch, Kuchen, Muffins verarbeitet werden. THC ist auf Grund seiner Lipophilie ohne Emulgator nicht intravenös applizierbar. Aufgrund seiner schlechten Wasserlöslichkeit kann es in Form von Lösungen oder Emulsionen mit Ethanol, Dimethylsulfoxid, Tween 80, Cremophor EL oder Polyvinylpyrrolidon verabreicht werden.
Pharmakologie
Wirkmechanismen
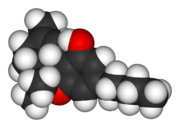 Kalottenmodell des Tetrahydrocannabinol.
Kalottenmodell des Tetrahydrocannabinol.Der Wirkmechanismus der Cannabinoide ist in seiner Gesamtheit wenig verstanden.
THC wirkt u. a. auf mindestens zwei Arten von Rezeptoren, die bei Säugetieren vorkommen, CB1 und CB2. CB1-Rezeptoren befinden sich vorwiegend in zentralen und peripheren Nervenzellen, wo sie die Ausschüttung von Neurotransmittern modulieren. Sie kommen aber auch in anderen Zellen vor, z. B. in der Hypophyse, Immunzellen, gastrointestinalem Gewebe, sympathetischen Ganglien, Herz, Lunge, Harnblase und Nebennieren. CB2-Rezeptoren kommen hauptsächlich in Immunzellen vor und sind an der Zytokinausschüttung beteiligt.
Endocannabinoide sind körpereigene Substanzen, die auf die CB1- und CB2-Rezeptoren wirken. Sie sind Eikosanoide und werden vom Organismus bei Bedarf erzeugt. Die bekanntesten sind Arachidonylethanolamid (Anandamid) und 2-Arachidonylglycerol (2-AG). Die Endocannabinoide und die Cannabinoid-Rezeptoren bilden das sogenannte Endocannabinoid-System.
THC bindet an die CB1-Rezeptoren und sorgt so für eine Reizübertragung in diesen Synapsen, mit Auswirkungen auf das zentrale und periphere Nervensystem, wie Glücksgefühl, Entspannung und Analgesie (Schmerzlinderung). Die Aktivierung hemmt über G-Proteine die Adenylylcyclase, blockiert Ca2+-Kanäle und aktiviert K+-Kanäle. Die Transduktionsmechanismen ähneln hierbei den Opioidrezeptor-Subtypen μ, δ und κ.
Über die Rolle der CB2-Rezeptoren ist weniger bekannt, man nimmt jedoch an, dass sie an der Immunomodulation beteiligt sind, weil sie vorwiegend in B-Zellen und in natürlichen Killerzellen vorkommen.
THC wirkt auch auf andere pharmakologische Ziele wie z. B. auf 5-HT3-Rezeptoren und auf Capsaicin empfindliche perivaskuläre sensorische Nerven.
Das Verteilungsmuster der CB1-Rezeptoren im Gehirn bedingt viele der pharmakologischen Eigenschaften von THC. Im Stammhirn, wo lebenswichtige Funktionen wie Atmung koordiniert werden, sind nur sehr wenige bis gar keine dieser Rezeptoren vorhanden. Im Hippocampus, wo das Kurzzeitgedächtnis angesiedelt ist, finden sich hingegen viele dieser Rezeptoren. CB1-Rezeptoren in den Basalganglien bieten eine Erklärung für den Einfluss von THC auf die Motorik.
Das nicht psychoaktive Cannabidiol (CBD) hat neben eigenen therapeutischen Wirkungen einen modulierenden Einfluss auf THC. Sowohl THC als auch CBD wirken antioxidativ und entfalten so eine neuroprotektive Wirkung, z. B. bei Glutamat-induzierter Exzitotoxizität. Darüber hinaus hemmt THC die Glutamat-Ausschüttung und/oder den Eintritt von Calcium über die Ionenkanäle und wirkt so zusätzlich neuroprotektiv.
Das in Cannabis in geringer Menge enthaltene Δ8-Tetrahydrocannabinol (Δ8-THC) ist psychoaktiv, aber etwas weniger potent als Δ9-THC.
THC und CBD können Zeichen des apoptotischen und nekrotischen Zelltods induzieren.
Metabolismus
Δ9-THC wird im Menschen überwiegend zu 11-Hydroxy-Δ9-THC (11-OH-Δ9-THC) oxidiert. Dieses Stoffwechselprodukt ist ebenfalls psychoaktiv und wird weiter zu 11-Nor-9-carboxy-Δ9-THC (11-COOH-THC, THC-COOH, THC-Carbonsäure, nicht psychoaktiv) verstoffwechselt. In Menschen und Tieren wurden über 100 verschiedene Δ9-THC-Metabolite identifiziert, nahezu alle sind nicht psychoaktiv.[5] Die Metabolisierung findet im Wesentlichen in der Leber und durch die Cytochrom P450 Enzyme 2C9, 2C19 und 3A4 statt. Die Metaboliten werden dann aufgrund ihrer lipophilen Eigenschaften im Fettgewebe eingelagert, woraus sie anschließend nur sehr langsam wieder entfernt werden.[5] Mehr als 65 % des ursprünglich vorhandenen THCs werden so in Form von Metaboliten im Stuhl ausgeschieden und ca. 25 % im Urin, ein geringer Teil wird im Körper selbst abgebaut.[5] Die Hauptmetaboliten im Urin sind mit Glucuronsäure verestertes THC-COOH und freies THC-COOH, während im Stuhl 11-OH-THC dominiert.[6]
Toxizität
Die LD50 bei der Maus beträgt 42 mg/kg Körpergewicht intravenös und 482 mg/kg bei oraler Verabreichung, beim Rhesusaffen tritt nach intravenöser Gabe von 128 mg/kg Körpergewicht der Tod durch Atemstillstand und Herzversagen ein.[7]
Der LD50-Wert wird am Menschen nicht ermittelt und lässt sich nicht verlässlich hochrechnen. Nimmt man in einer groben (und niedrig angesetzten) Schätzung, den potentiellen peroralen LD50-Wert für Menschen mit 150 mg/kg Körpergewicht an, dann würde eine 70 kg schwere Person nach oralem Akut-Konsum von 10,5 g THC mit einer Wahrscheinlichkeit von 50 % sterben. Diese Menge ist enthalten in rund 130–260 g eines Cannabisprodukts mit 4–8 % THC-Gehalt. Andere Autoren geben niedrigere Werte von etwas über 4 Gramm an.[5] Zu beachten ist jedoch, dass THC über den Darm erheblich schlechter resorbiert wird als über die Lunge[8], und dies durch beide nicht unbegrenzt. Deshalb ist es nicht möglich, sich die angegebenen letalen Mengen THC durch die Einnahme natürlicher Cannabisprodukte zuzuführen, weshalb beim Menschen bisher kein Fall einer Überdosis mit Todesfolge bekannt wurde.
Pharmakokinetik
Psychische Effekte treten bei folgenden Dosierungen auf: 30–50 μg/kg intravenös, 50 μg/kg bei Rauchinhalation, 120 μg/kg oral.[9] Bei Rauchinhalation geringerer Mengen THC (5-7 mg) überwiegt die sedative Komponente, bei Mengen von 15 mg oder darüber überwiegt Vigilanz, die sich bis zu psychotischen Zuständen steigern kann.
Bei Rauchinhalation gehen ca. 20 % des im Rauch vorhandenen Δ9-THC in das Blut über, oral nur etwa 6 %.[10] THC geht vom Rauch sehr schnell ins Blut über, hierbei ist die Entwicklung der Plasmakonzentration mit intravenöser Einnahme vergleichbar. Bei oraler Einnahme in Form von Sesamölkapseln war die Wirkung wegen des First-Pass-Effekts vermindert, die Bioverfügbarkeit betrug nur ca. 10 bis 20 %, die höchste THC-Konzentration wurde nach etwa 2 Stunden erreicht.
THC ist im Blutplasma überwiegend an Proteine gebunden, max. 10 % kommen in den roten Blutkörperchen vor. Die Plasmahalbwertszeit nach intravenöser Gabe entwickelt sich in vier Phasen, was nahelegt, dass es mindestens vier Gewebearten gibt, in die THC einsickert, mit jeweils unterschiedlicher Durchlässigkeit und Bindungskapazität. Die THC-Konzentration fällt zunächst in wenigen Minuten stark ab, und sinkt dann langsam weiter. Die Halbwertszeiten betragen jeweils 1 Minute, 4 Minuten, 1 Stunde und 19 Stunden. Die kurzen Halbwertszeiten (1 und 4 Minuten, 1 Stunde) sind auf den schnellen Übergang von THC in bestimmte Gewebearten sowie auf den schnellen Stoffwechsel der Substanz zurückzuführen. Nach ungefähr 6 Stunden besteht ein Pseudogleichgewicht zwischen dem THC-Gehalt im Plasma und in den Geweben. Nach 5 Tagen werden ca. 80 bis 90 % der THC-Dosis in Form von Metaboliten ausgeschieden, etwa zu zwei Dritteln im Stuhl und zu einem Fünftel im Harn.
Die THC-Konzentration im Gehirn erreicht nach ca. 30 Minuten ihr Maximum, sie ist dabei ca. 3 bis 6 Mal höher als im Plasma. Die THC-Konzentrationskurven im Gehirn und im Plasma verlaufen parallel, was für einen uneingeschränkten Übertritt ins Gehirn spricht. Tierversuche haben gezeigt, dass sich THC als lipophile Substanz in bestimmten Gewebearten stark anreichert, z. B. in Körperfett, Herz, Leber und Lunge. Ebenso wurde im Tierversuch nachgewiesen, dass THC durch die Plazenta auf Föten übergeht und deren Entwicklung beeinflusst, wobei die Auswirkungen noch nicht hinreichend erforscht sind.[11]
Synthetische Analoga
Synthetische Analoga Wirkstoff Wirkung Δ6a,10a-THC ev. psychoaktiv Δ6a,10a-Hexyl-THC Synhexyl (Parahexyl), schwächere Wirkung als Δ9-THC Δ6a,10a-Dimethylheptyl-THC DMH-THC, tlw. psychoaktiv Δ6a,10a-Methyloctyl-THC Dimethylheptylpyran DMHP, CB1-Agonist, potenter als Δ9-THC Nabilon Antiemetikum, psychoaktiv Levonantradol Antiemetikum, psychoaktiv CP 55,940 rund 45 Mal so potent wie Δ9-THC BRL 4664 Wirkungen
Bekannte Wirkungen von Δ9-THC auf den Menschen bzw. Wirkungen von Cannabis, welche auf Δ9-THC zurückgeführt werden:[12]
Wirkungen Effekte mit therapeutischem Potenzial Effekte des "high" Andere Wirkungen - Analgesie, Linderung neuropathischer und entzündungsbedingter Schmerzen
- Wirkung auf motorische Funktionen, Linderung von Spastizität
- Neuroprotektion
- Hemmung der gastrointestinalen Motilität
- Antiemetische Wirkung
- Senkung des Augeninnendrucks
- Erleichterung des Schlafes
- Appetitanregende Wirkung
- Hemmende Wirkung auf die Ausbreitung von Krebszellen
- Stimmungssteigerung
- Lachen
- Redseligkeit
- veränderte Wahrnehmung (z. B. in Bezug auf Farben, Musik und Zeitgefühl)
- Gefühle erhöhter Einsicht und Bedeutung
- Beeinträchtigung des Denk-, Lern- und Erinnerungsvermögens
- Beeinträchtigung des Konzentrationsvermögens
- Beeinträchtigung der psychomotorischen Leistung, Ataxie, Tremor
- Gefühle von Unwirklichkeit, Depersonalisation und Distanziertheit
- Unterbrechung von Gedankengängen
- Panik, Angst, Dysphorie
- Verschlimmerung psychotischer Symptome, Paranoia
- Auswirkungen auf kardiovaskuläre Funktionen, einschließlich Tachykardie und Haltungshypotonie
- Bindehautrötung, verminderter Tränenfluss, Mundtrockenheit
- Übelkeit und gelegentlich Erbrechen
- Wirkungen auf endokrine und reproduktive Funktionen
- Wirkungen auf die Thermoregulation
Die wiederholte Einnahme von Δ9-THC kann bei Mensch und Tier Toleranz und Abhängigkeit bewirken. Die Toleranz ist reversibel und dürfte auf eine Verringerung der Rezeptordichte oder des Rezeptor-Signalverhaltens zurückzuführen sein. Änderungen der Affinität von Δ9-THC auf die Rezeptoren, Veränderungen des Stoffwechsels und pharmakokinetische Effekte dürften hierbei eine geringere Rolle spielen.
Werden THC-haltige Pflanzenteile geraucht, kommen die Risiken des Rauchens hinzu: Arteriosklerose, sowie ein signifikant erhöhtes Risiko von Herz- und Hirninfarkten, Mund-, Kehlkopf-, Lungen- und Blasenkrebs. Bei dem sehr verbreiteten Mischen mit Tabak kommen alle Gefahren der Nikotinsucht hinzu.
Es bestehen keine Hinweise, dass THC mutagen, cancerogen oder teratogen (fruchtschädigend) ist. Trotzdem sollten Schwangere und Stillende auf den Konsum von THC verzichten, weil Schäden am ungeborenen oder gestillten Kind nicht sicher ausgeschlossen werden können.
Medizinische Anwendung
Das halbsynthetische THC Dronabinol ist in Deutschland und anderen Staaten als verschreibungspflichtiges Betäubungsmittel (Handelsname Marinol®) zur Behandlung von Anorexie und Kachexie bei AIDS und als Antiemetikum im Rahmen einer Krebstherapie zugelassen. Das vollsynthetische THC-Analogon Nabilon hat ähnliche Indikationen. Das THC-Analogon Levonantradol wird in Deutschland nur für Forschungszwecke genutzt. Außerdem befindet sich THC in der klinischen Erprobungsphase für die Behandlung von Glaukomen und Autoimmunerkrankungen, wie Multipler Sklerose, Morbus Crohn oder Colitis ulcerosa. Dass THC Tics bei Betroffenen des Tourette-Syndroms wirksam reduziert, bestätigten die Ergebnisse einer sechswöchigen Studie an der Medizinischen Hochschule Hannover.
In den Niederlanden werden unter staatlicher Kontrolle drei standardisierte Cannabis-Varietäten für medizinische Zwecke erzeugt: Bedrocan (THC ca. 18 %; CBD <1 %), Bedrobinol (THC ca. 13 %; CBD <1 %) und Bediol (THC ca. 5 %; CBD ca. 6 %).[13] Diese Arzneimittel sind zwar verschreibungsfähig, aber nicht erstattungsfähig.
In Kanada, Großbritannien und Spanien ist ein Mundspray mit den Handelsnamen Sativex® (Wirkstoffe: pflanzliches THC und Cannabidiol) für die Behandlung neuropathischer Schmerzen und Spasmen bei multipler Sklerose sowie zur Behandlung von Schmerzen, Übelkeit und Erbrechen in Zusammenhang mit Krebs- und AIDS-Erkrankungen zugelassen. In den USA befand sich das Medikament im Jahr 2008 in der klinischen Versuchsphase III.
Drogennachweis
Die Nachweisdauer von THC beträgt in Abhängigkeit vom Konsum 2–35 Tage im Urin bzw. 12 Stunden im Blut. Der Nachweis im Urin erfolgt meist über die THC-Metabolite THC-Carbonsäure und 11-Hydroxy-THC. Neben der vergleichsweise aufwändigen LC/MS-Methode existieren für den Nachweis von THC-Metaboliten im Harn eine Reihe von Immunoassay-Tests wie z. B. Radioimmunoassay (RIA), EMIT (enzyme multiplied immunoassay technique), CEDIA (cloned enzyme donor immunoassay) und FPIA (fluorescence polarization immunoassay). Um die Zahl falsch positiver Ergebnisse mit diesen Tests zu reduzieren, empfiehlt die US-amerikanische Substance Abuse and Mental Health Services Administration (SAMHSA) einen Cutoff-Wert von 50 ng/mL.[14] Zur hochspezifischen und hochsensitiven Quantifizierung der THC-Carbonsäure im fg-Bereich kann die GC/MS-Methode eingesetzt werden. Dabei werden hochfluorierte Derivate, wie z. B. das THC-COOH-HFBA-PFPOH-Derivat unter Verwendung des deuterierten Derivats als internem Standard nach dem Prinzip der Isotopenverdünnungsanalyse mit der NCI-Technik (Negative Chemische Ionisation) vermessen. Diese Methodik vermeidet die oben geschilderten Probleme der falsch positiven oder falsch negativen analytischen Ergebnisse, die bei Enzymimmunoassays immer wieder beobachtet werden und findet daher auch in der forensischen Analytik bei Schiedsanalysen Verwendung.[15]
Falsch negative Ergebnisse können etwa durch verdünnte Harnproben verursacht werden, z. B. bei einer Verdünnung in vivo durch vermehrte Flüssigkeitszufuhr. Über die Verdünnung des Harns können der Creatinin-Gehalt und die Osmolalität Anhaltspunkte bieten, jedoch herrscht Uneinigkeit darüber, ab welchem Creatinin-Wert eine Harnprobe als „unverdünnt“ gilt.
Falsch positive Ergebnisse wurden bei einigen intensivmedizinisch behandelten Patienten berichtet, außerdem bei Personen, welche den Cannabiskonsum zwar aufgegeben haben, jedoch mehr Sport betreiben: da THC im Fettgewebe gespeichert wird, können beim Abbau von Fettreserven THC-Metabolite freigesetzt werden.[16]
THC im Straßenverkehr
THC wirkt auf das Zentralnervensystem, deshalb sollte nach dem Konsum auf das Benutzen von Maschinen und das Führen von Fahrzeugen verzichtet werden. Die Polizei kann bei Fahrerkontrollen mit einem Schweiß-, Speichel-, Urintest oder durch Untersuchung des Blutes auch längere Zeit nach dem Konsum Spuren von THC nachweisen. Die Nachweisdauer hängt vor allem vom jeweiligen Konsummuster (Dauer, Art der Einnahme, Frequenz, Dosis) ab und kann im Urin zwischen einer Woche und zwei Monaten betragen. Zur Zeit ist die gesetzliche Situation allerdings noch nicht eindeutig beschlossen, es drohen aber Geldbußen von mindestens 500 Euro, Fahrverbote bis zu drei Monaten und vier Punkte in Flensburg. Die Polizisten vor Ort können nur orientierende Vortests durchführen, die Blutprobe wird später in einem Labor untersucht und die Menge an THC und seiner Abbauprodukte bestimmt. Rechtlich sieht es so aus, dass eine Ordnungswidrigkeit begangen wurde, wenn noch THC im Blut nachweisbar ist. Im Beschluss des Bayerischen VGH vom 25. Januar 2006, Az. 11 CS 05.1711, steht: Der derzeitige medizinisch-naturwissenschaftliche Erkenntnisstand rechtfertigt es nicht, bereits ab einer THC-Konzentration von 1,0 ng/ml im Blut eines Kraftfahrzeugführers eine Erhöhung des Risikos für die Verkehrssicherheit als derart gesichert im Sinne des § 11 Abs. 7 FeV anzusehen, dass dem Betroffenen ohne weitere Sachverhaltsaufklärung die Fahrerlaubnis zwingend zu entziehen ist. Bei gelegentlichem Konsum von Cannabis und Fahren mit einer THC-Konzentration zwischen 1,0 und 2,0 ng/ml ist vor einer etwaigen Entziehung der Fahrerlaubnis gemäß § 14 Abs. 1 S. 4 FeV ein medizinisch-psychologisches Gutachten einzuholen.FeV § 11 Abs. 7, FeV § 14 Abs. 1 S. 4, StVG § 3 Abs. 1 Dies gilt aber nur, wenn keine Fahrfehler gemacht wurden. In vielen Fällen ordnet die Verwaltungsbehörde (Fahrerlaubnis) eine Überprüfung der Kraftfahreignung (MPU) zum Nachweis der Kraftfahrtauglichkeit an.
Versuche mit chronisch kranken MS-Patienten haben jedoch den Verdacht nahegelegt, dass eine Behandlung mit THC oder THC-ähnlichen Stoffen keinesfalls die Fahrtüchtigkeit beeinträchtigt. Tests mit mehreren Versuchspersonen, die teilweise nur ein Placebo erhielten, haben dies bestätigt.
In der Schweiz ist seit Anfang 2005 ebenfalls mit einem Drogentest (engl. „Drug Wipe“) an Verkehrskontrollen zu rechnen, trotz des Gerüchts, dass die von der Polizei eingesetzten Schnelltests in über 80 % der Fälle falsche Resultate liefern.[17][18]
Die Methode des THC-Nachweises im Straßenverkehr ist umstritten, da der Konsument nicht unter direktem Einfluss der Droge stehen muss, sondern es für einen positiven Test ausreicht, Tage und Wochen zuvor THC konsumiert zu haben. Dies gilt für alle Urintests, da diese nicht direkt THC nachweisen, sondern ein Abbauprodukt des THC, die Tetrahydrocannabinolsäure (THC-COOH, auch THC-Carbonsäure genannt). Die Cannabinolsäure hat keine berauschende Wirkung mehr. Sie wird allerdings relativ langsam und je nach Konstitution verschieden schnell aus dem Körper ausgeschieden und ist somit längere Zeit, manchmal sogar über Wochen im Urin nachweisbar. Die derzeit zuverlässigste Nachweismethode ist die Gaschromatographie mit Massenspektrometrie-Kopplung (GC/MS) von Derivaten (häufig als Trimethylsilyl-Derivate) der THC-Carbonsäure.[19] Im Gegensatz dazu weisen Speichel- und Schweißtests wie die oben zitierten Drogentests THC mit ausreichender Empfindlichkeit direkt nach.
THC-Gehalte gängiger Schwarzmarktprodukte
Konventionelles, in Mitteleuropa gewachsenes Freiland-Marihuana enthält im Schnitt rund 6 % THC, während unter Kunstlicht gewachsenes, speziell auf hohen THC-Gehalt gezüchtetes Marihuana (fälschlich auch als „Genhanf“ bekannt) einen Wirkstoffgehalt von etwa 20 % vorweisen kann. In den USA begann man in den 1970er Jahren mit solchen Züchtungen; insbesondere in den Niederlanden setzte man diese seit den 1980er Jahren fort, so dass der durchschnittliche THC-Gehalt des sogenannten „Nederwiet“ zuletzt (2004) bei etwa 20 % lag. Dennoch sind Meldungen über angeblich bis zu 50-fach erhöhte THC-Gehalte als maßlos übertrieben zu betrachten. US-Forscher wiesen darauf hin, dass die als zum Vergleich angegebenen äußerst niedrigen Werte für in den 60er/70er Jahren beschlagnahmtes Cannabis (z. T. unter 1 %) darauf zurückzuführen sein dürften, dass seinerzeit die ganzen Pflanzen inklusive Stängel und Blätter analysiert wurden, während heute nur die tatsächlich konsumierten Blütenstände untersucht werden.
Haschisch enthält im Schnitt zwischen 5 und 10 % THC, wobei – wie auch bei Marihuana – die Spanne sehr groß sein kann: Hochwertiges Haschisch kann ebenfalls über 20 % THC enthalten. Das in den Niederlanden aus hochwertigem Marihuana hergestellte Haschisch (welches jedoch nur einen sehr kleinen Marktanteil hat) enthält mitunter bis zu 40 % THC. Eine Studie der Universität Leiden aus dem Jahre 2006 untersuchte elf Cannabiskraut-Proben aus niederländischen Coffee-Shops, der THC-Gehalt lag zwischen 11,7 % und 19,1 %. Zwei Vergleichsproben von Cannabiskraut aus niederländischen Apotheken enthielten 12,2 % bzw. 16,5 % THC.[20]
Das auf dem Schwarzmarkt eher selten erhältliche Haschischöl kann je nach Produktionsweise bis zu 90 % THC enthalten. Werden „billige“ Lösemittel von mäßigem Reinheitsgrad eingesetzt, die giftige Beiprodukte oder Vergällungsstoffe enthalten, oder werden Lösemittel nur ungenügend entfernt, kann der Konsum zu zusätzlichen Gesundheitsschäden führen.
Einzelnachweise
- ↑ a b Tetrahydrocannabinol bei ChemIDplus
- ↑ Sicherheitsdatenblatt von Caelo
- ↑ Gaoni, Y. & Mechoulam, R.: Isolation, structure and partial synthesis of an active constituent of hashish. J. Amer. Chem. Soc. 86:1646-7, 1964.
- ↑ E. Breitmeier: „Alkaloide“, S. 87 ff, Teubner Verlag, 1997
- ↑ a b c d Grinspoon, Lester / Bakalar James B.: Marihuana, die verbotene Medizin, 1994, ISBN 3-86150-060-4
- ↑ Huestis M. A.: Pharmacokinetics and metabolism of the plant cannabinoids, Δ⁹-tetrahydrocannabinol, cannabidiol and cannabinol. In: Handb Exp Pharmacol. Nr. 168, 2005, S. 657–690. PMID 16596792
- ↑ Eberhard Teuscher, Ulrike Lindequist: Biogene Gifte. Akademie-Verlag, 1988 Berlin, ISBN 3-05-500314-4 (Seite 65f „Letale Dosen von THC bei Maus und Rhesusaffe“)
- ↑ Nahas G. G. (1972): Bull. Narc., 24 (2). 11–27
- ↑ R. G. Pertwee: The central neuropharmacology of psychotropic cannabinoids. Pharmac. Ther. Vol. 36, pp. 189 to 261, 1988; PMID 3279430.
- ↑ Aktories/Förstermann/Hofmann/Starke: Allgemeine und spezielle Pharmakologie und Toxikologie9, Urban & Fischer 2005.
- ↑ C. N. Chiang, R. S. Rapaka: Pharmacokinetics and Disposition of Cannabinoids. In: Structure-Activity Relationships of the Cannabinoids. NIDA Research Monograph 79, 1987. [1]
- ↑ Roger G. Pertwee: Pharmacologial and therapeutic targets for Δ9-tetrahydrocannabinol and cannabidiol. Euphytica 140: 73-82, 2004. doi:10.1007/s10681-004-4756-9
- ↑ Frederike K. Engels et al.: Medicinal cannabis in oncology. European Journal of Cancer 43(18), December 2007, pp. 2638-2644. doi:10.1016/j.ejca.2007.09.010
- ↑ Sandra B. Grauwiler, Jürgen Drewe, Andre Scholer: Sensitivity and Specificity of Urinary Cannabinoid Detection With Two Immunoassays After Controlled Oral Administration of Cannabinoids to Humans. Ther Drug Monit, Vol. 30, No. 4, August 2008, 530–535; PMID 18641545.
- ↑ Gustafson RA. et al.:Urinary cannabinoid detection times after controlled oral administration of delta9-tetrahydrocannabinol to humans. Clin Chem. 2003 Jul;49(7):1114-24. PMID 12816908 doi:10.1373/49.7.1114
- ↑ G. Halwachs-Baumann: Labormedizin. Klinik - Praxis - Fallbeispiele. Springer, Wien - New York 2006.
- ↑ Unzuverlässiger Speicheltest bei Drogen (Neue Zürcher Zeitung vom 24. Januar 2005 zitiert im Hanfarchiv)
- ↑ Jagd auf Kiffer nach dem Prinzip Zufall (Solothurner Tagblatt vom 21. Januar 2005 zitiert im Hanfarchiv)
- ↑ Rapid screening of drugs of abuse and their metabolites by gas chromatography/mass spectrometry: application to urinalysis. Rapid Commun Mass Spectrom. 2005;19(11):1529-35
- ↑ Eine Beurteilung der Qualität von medizinischem Cannabis in den Niederlanden (Cannabinoids 2006; 1(1):1–10 (13.08.2006))
Literatur
- Roger Pertwee (Hrsg.): Cannabinoids. (Handbook of Experimental Pharmacology Bd. 168), Springer, Berlin/Heidelberg 2005. ISBN 3-540-22565-X.
- Franjo Grotenhermen (Hrsg.): Cannabis und Cannabinoide. Pharmakologie, Toxikologie und therapeutisches Potential. Verlag Hans Huber, Bern/Göttingen/Toronto/Seattle 2004. ISBN 3-456-84105-1.
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.