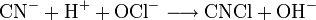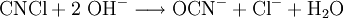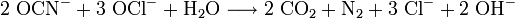- Zyanid
-
Cyanide sind Salze und andere Verbindungen der Blausäure (Cyanwasserstoff, HCN). In der organischen Chemie sind Cyanide mit der allgemeinen Formel R–C≡N eine veraltete, aber durchaus noch gebräuchliche Bezeichnung für Nitrile. Der Name Cyanid leitet sich vom griechischen κυανός (blau) ab und rührt von der Gewinnung aus Eisenhexacyanoferrat (Berliner Blau) her, einem nicht sehr beständigen Pigment mit blauer Farbe.
Inhaltsverzeichnis
Eigenschaften
Die salzartigen Cyanide enthalten das Cyanid-Anion [C≡N]−, die organischen Cyanide die funktionelle Gruppe –C≡N. Wasserlösliche Cyanide werden an feuchter Luft teilweise hydrolysiert und riechen dadurch nach Blausäure.
Einfache Verbindungen
Alle Cyanide der Alkali- und Erdalkalimetalle sind hochgiftig und in Wasser leicht löslich, wie zum Beispiel Kaliumcyanid (Zyankali). Die Giftigkeit dieser Salze liegt an der Freisetzung der Blausäure bei der Reaktion mit der Salzsäure des Magens:
Kaliumcyanid ist ein wichtiger Bestandteil in der Galvanik.
Komplexverbindungen (Cyanoverbindungen)
Das Cyanid-Anion ist sehr reaktiv und bildet mit anderen Metallen (abgesehen von Alkali- und Erdalkalimetallen) z. B. mit Eisen häufig sehr stabile Verbindungen. In vielen Fällen bildet sich ein neues Anion, das aus einem Metall und aus einer festen Anzahl (oft vier oder sechs) Cyanid-Bausteinen besteht. Das Metall bildet die Mitte und wird von den Cyanidionen umgeben (z. B. [Fe(CN)6]4−). Es hat sich ein Verbindungstyp gebildet, der als Komplex bezeichnet wird. Mit Kationen kann sich ein Salz bilden (z. B. K4[Fe(CN)6], Kaliumhexacyanoferrat(II), das sogenannte gelbe Blutlaugensalz). In vielen Komplexverbindungen ist das Cyanid so fest gebunden, dass es seine Giftigkeit (Reaktivität) verloren hat, allerdings lässt sich die Blausäure zum Beispiel durch Zugabe heißer verdünnter Schwefelsäure freisetzen, es ist daher trotzdem mit einer gewissen Vorsicht zu handhaben. Konzentrierte Schwefelsäure setzt keine Blausäure frei, da es die entstehende Blausäure sofort oxidiert. Analytisch lässt sich allerdings in wässrigen Lösungen der Komplexe unmittelbar kein Cyanid nachweisen.
Verwendung von Komplexverbindungen in der Lebensmittelindustrie
In der Lebensmittelindustrie werden die Cyano-Komplexe Natriumferrocyanid (E 535, Natriumhexacyanoferrat(II)), Kaliumferrocyanid (E 536, Kaliumhexacyanoferrat(II)) und Calciumferrocyanid (E 538, Calciumhexacyanoferrat(II)) als Lebensmittelzusatzstoff verwendet. Die Salze sind in geringen Mengen als künstliche Rieselhilfe, Trennmittel und Stabilisator für Kochsalz und Kochsalzersatz zugelassen.
Giftwirkung
Der Mechanismus der Cyanid-Vergiftung erfolgt durch Hemmung des Enzyms Cytochrom-c-Oxidase in der Atmungskette. Antidote: 4-Dimethylaminophenol-Hydrochlorid (4-DMAP), Natriumthiosulfat, Hydroxocobalamin (Vitamin B12a) = Cyanokit, Amylnitrit.
Nachweis
Der qualitativ chemische Nachweis von Cyaniden erfolgt mit Fe3+-Ionen in salzsaurer Lösung nach Umsetzung mit Ammoniumpolysulfid. Dabei entsteht das tiefrot gefärbte Eisenthiocyanat Fe(SCN)3. Allerdings muss beachtet werden, dass dieser Nachweis in Anwesenheit von Fe(II), wegen der Bildung von Berliner Blau, einem Komplex des Fe(II) mit dem Hexacyanoferrat(III) als Liganden, nicht funktioniert.
Entsorgung
Um Cyanide zu entsorgen, verwendet man ein geeignetes Oxidationsmittel, wie zum Beispiel Natriumhypochlorit (NaOCl) oder Wasserstoffperoxid (H2O2). Das Cyanid wird dabei in unschädlichen Stickstoff und Kohlenstoffdioxid überführt.
Weblinks
Wikimedia Foundation.