- Bisphosphoglycerat
-
Strukturformel 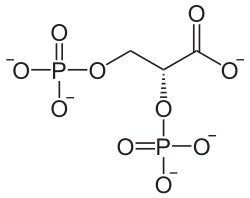
Allgemeines Name 2,3-Bisphosphoglycerat Andere Namen - 2,3-BPG
- 2,3-Diphosphoglycerat
- 2,3-DPG
Summenformel C3H8O10P2 CAS-Nummer 138-81-8 Kurzbeschreibung Feststoff Eigenschaften Molare Masse 266,037 g·mol−1 Aggregatzustand fest
Löslichkeit wenig löslich in Wasser: 10,2 g·l−1 (? °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung 
unbekannt R- und S-Sätze R: ? S: ? Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 2,3-Bisphosphoglycerat (2,3-BPG), auch 2,3-Diphosphoglycerat (2,3-DPG) genannt ist ein C3-Körper mit je einer geladenen Phosphatgruppen am 2. und 3. C-Atom. Es weist des Weiteren am ersten C-Atom eine geladene Carboxylgruppe auf. Insgesamt ist es in Lösung (Blut) fünffach negativ geladen. Es wird im Rapoport-Luebering-Zyklus, einem Nebenweg der Glykolyse, aus 1,3-Bisphosphoglycerat mithilfe der Bisphosphoglyceratmutase gebildet. Unter physiologischen Bedingungen werden etwa 20 Prozent des während der (anaeroben) Glykolyse der Erythrozyten anfallenden 1,3-Phosphoglycerats zu 2,3-BPG umgewandelt, die restlichen 80 Prozent durchlaufen via 3-Phosphoglycerat den Hauptweg der Glykolyse.
2,3-BPG spielt bei der Regulation des Hämoglobins (Hb) eine entscheidende Rolle. Bindet es an die Tense-Form des Hämoglobins (Desoxyhämoglobin), wird diese Form stabilisiert und kann nicht in die sauerstoffaffine R-Form übergehen. Sauerstoff wird somit auch noch bei einem höheren Partialdruck vom Hämoglobin abgegeben als ohne das T-Form-stabilisierende 2,3-BPG. 2,3-BPG erschwert eine weitere Oxygenierung von Hämoglobin respektive erleichtert es die Abgabe des an Hb gebundenen Sauerstoffs. Damit wird das Gleichgewicht der Sauerstoffbindungskurve (HbO2 ↔ Desoxy-Hb) nach rechts, d. h. auf die Seite des Desoxy-Hb verschoben. Somit ist es plausibel, dass auch mehr Sauerstoff abgeben werden kann, bei relativ reduzierter Sauerstoffaufnahme. Das Phänomen der Rechtsverschiebung der Sauerstoffbindungskurve hat praktische Konsequenzen für das Bergsteigen und das Tauchen. Im Höhentraining wird dieser Umstand benutzt, um zuerst den 2,3-BPG-Wert ansteigen zu lassen, wodurch EPO-vermittelt eine verstärkte Erythropoese erreicht wird.
Die Arthropoden besitzen als respiratorisches Pigment das Hämocyanin. Hier übernimmt das Lactat die Funktion des 2,3-DPG und führt zu einer Verschiebung des mittleren Teils der Sauerstoffbindungskurve nach rechts. In Blutkonserven muss 2,3-BPG durch ein Analogon wie etwa Glucose oder Inosin ersetzt werden, weil es instabil ist und schnell zerfällt. Im Körper wird es ständig neu synthetisiert. Das Gamma-Globulin des fetalen Hämoglobins (HbF) hat eine geringere Affinität zu 2,3-Bisphosphoglycerat. Damit erhöht sich im Vergleich zum adulten Hämoglobin (HbA) die Affinität des fetalen Hämoglobins zu Sauerstoff. Das ermöglicht eine leichte Übertragung von Sauerstoff von der Mutter zum Fetus.
Quellen
Wikimedia Foundation.
