- Bt-Toxin
-
Bt-Toxin bezeichnet einen Giftstoff (Toxin), die von der Bakterienart Bacillus thuringiensis produziert werden kann. Dabei handelt es sich um ein Protein.
Viele Bacillus-thuringiensis-Stämme (Bt) produzieren diese (Prä-)Proteine, die sich in kristallinen Einschlüssen während der Sporulation anlagern. Im Darm des Zielorganismus werden diese Kristalle aufgelöst und die Präproteine geschnitten. Dabei entstehen funktionsfähige Proteine, die nur in den Stoffwechsel des Zielorganismus eingreifen und somit als Insektizid wirken, welche entweder der Gruppe der crystal toxins (Cry) oder der cytolytic toxins (Cyt) zugerechnet werden. Die Wirksamkeit und Spezifität des Bt-Cry-Toxins haben es zu einem weit verwendeten Mittel in der Landwirtschaft werden lassen. Es gilt - mit Ausnahme seiner Antagonisten (z. B. des Maiszünslers) - für andere Organismen, wie den Menschen, als ungiftig und ist daher z. B. auch im ökologischen Landbau ein zertifiziertes Mittel.
Inhaltsverzeichnis
Wirkungsweise
Cry-Toxine werden als Prototoxine gebildet und entfalten unter bestimmten Einflüssen im Insektenkörper ihre Wirkung. Das Prototoxin kann sich nur im alkalischen Milieu, wie im Verdauungstrakt der Insekten, lösen. Artspezifische Proteasen schneiden dann das aktive toxische Zentrum frei, welches bis dahin am N-Terminus des Prototoxins hing. Das Toxin erkennt bestimmte Kohlenwasserstoffstrukturen an der Oberfläche von Zellen im Verdauungstrakt der Insektenlarven und verursacht dort die Bildung von Poren, die das osmotische Potential der Zelle zerstören und damit Zelllysis bewirken.
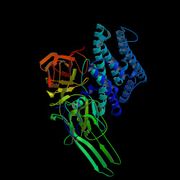
Aufbau des Bt-Toxins
Cry-Toxine bestehen aus drei Domänen. Eine Domäne besteht großteils aus α-Helices, die anderen beiden aus β-Faltblattstrukturen. Homologien zwischen den einzelnen Cry-Toxinen finden sich nur in fünf strukturerhaltenden Bereichen im Inneren des Proteins, während alle anderen unterschiedlich auf die spezifischen Wirtsbedingungen zugeschnitten sind.
Die α-Helices-Domäne (I) besteht aus sieben Helices, die für die Entstehung der Membranporen zuständig sind. Während die zentrale Helix hydrophob, also wasserabweisend ist, verhalten sich alle anderen amphiphatisch: Die äußeren Bereiche sind hydrophil und die inneren hydrophob. Fünf der externen Helices sind lang genug um eine 30 ‰ Membran zu durchspannen. Dabei kommt es zu einer Inversion der hydrophob/hydrophilen Bereiche, so dass die Lipide der Membran an die hydrophoben Bereiche der Helices angrenzen.
Die zweite Domäne ist für die Bindung am Zell-Rezeptor verantwortlich. Sie besteht aus drei antiparallelen β-Flächen, die eine sogenannte β-Prisma-Struktur bilden. Jede der Flächen bildet eine Schleife auf einer Seite des Prismas aus, die als funktionelles Lektin Glykosylierungen an der Membranoberfläche erkennen und binden kann.
Die dritte Domäne besteht aus zwei ineinander verschlungenen β-Faltblatt-Strukturen, die eine sogenannte Jelly-roll-Oberfläche bilden. Ihre Funktion ist noch nicht vollständig erforscht, jedoch ist sicher, dass sie einen stabilisierenden Effekt auf das Protein hat. Die Domäne schließt ein Loch zwischen den anderen beiden Domänen und schützt das Toxin so vor Proteasen. Zum anderen enthält diese Domäne mindestens zwei Bindungsstellen, die - so wird angenommen - nicht nur wie Lektin spezifische Kohlenwasserstoffe, sondern auch Peptide binden können.
Siehe auch
Transgener Mais, da Bt-Mais
Weblinks
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.