- Β-Faltblatt
-
Als β-Faltblatt (engl. β-pleated sheet oder β-sheet ) bezeichnet man in der Biochemie ein Sekundärstrukturelement von Proteinen (Eiweißen). Für die Funktion dieser Stoffe ist es wesentlich, dass die Aminosäurenketten aus denen sie bestehen, in bestimmten dreidimensionalen Strukturen angeordnet („gefaltet“) sind.
Inhaltsverzeichnis
Historie
Ende der dreißiger Jahre führten die Amerikaner Pauling und Corey Röntgenuntersuchungen an kristallinen Peptiden durch. Dabei stellten sie fest, dass sich bestimmte räumliche Merkmale regelmäßig wiederholen: α-Helix und β-Faltblatt (Sekundärstruktur). Das β in "β-Faltblatt" macht keine wissenschaftliche Aussage, sondern stellt lediglich eine zeitliche Einordnung dar: Die Faltblattstruktur ist nach der Helixstruktur die zweite Struktur, die entdeckt worden ist. Dementsprechend wurde mit der Namensgebung verfahren. Der Name Faltblatt kommt von der dreidimensionalen Struktur eines solche Komplexes: Die "Zickzack-Form" ähnelt einem gefalteten Blatt.
Struktur
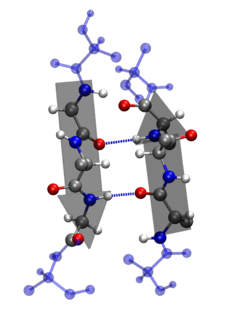
Auf Grund der Anwesenheit von Seitenketten sind β-Faltblätter nicht flach, sondern ziehharmonikaähnlich geriffelt (engl. pleated). Die Polypeptidketten eines Faltblattes bezeichnet man als β-Stränge. Diese Stränge können auf unterschiedliche Weise verknüpft sein:
- Antiparallele Verknüpfung (gegensinnig):
-
- Die Carbonyl- und Aminogruppen eines Strangs sind jeweils über Wasserstoffbrückenbindungen mit der Amino- und Carbonylgruppe des anderen Strangs verbunden
- Parallele Verknüpfung (gleichsinnig):
-
- Die NH-Gruppe des einen Strangs ist mit der CO-Gruppe des anderen Strangs über eine Wasserstoffbrücke verknüpft. Die Carbonylgruppe hingegen bildet eine Wasserstoffbrückenbindung mit der Aminogruppe aus, die zwei Reste entfernt vom jeweiligen Partner auf dem anderen Strang liegt. Durch diese Verbindungsweise ist jede Aminosäure des einen Strangs - mit Ausnahme der beiden Termini - mit zwei Aminosäuren des anderen Stranges verbunden. Die Stränge verlaufen in die gleiche Richtung und so sind die einzelnen Atome parallel zueinander angeordnet.
- Gemischte Verknüpfung:
-
- Bei der gemischten Verknüpfung bestehen sowohl parallele als auch antiparallele Verknüpfungen.
Die dreidimensionale Darstellung kann an ein gefaltetes Blatt erinnern: Die Peptidgruppen liegen wie in den Flächen und die dazwischenliegenden C-Atome wie in den Kanten eines mehrfach gefalteten Blattes. Dabei treten die Peptidbindungen mehrerer Ketten in Wechselwirkung. Es bilden sich die zur Stabilisierung notwendigen Wasserstoffbrückenbindungen entlang des Polypeptidrückgrats, welche in Zweierpaaren im Abstand von 7,0 Å vorkommen. Beim Faltblatt ist der Abstand zwischen vicinalen Aminosäuren im Vergleich zur deutlich kompakteren α-Helix viel größer: Der Abstand beträgt 0,35 nm im Vergleich zu 0,15 nm bei der Helix.
Die Seitengruppen liegen jedoch ziemlich dicht beieinander, so dass sperrige oder gleich geladene Reste die Anordnung stören. Größere Faltblatt-Strukturbereiche kommen nur dann zustande, wenn die Reste relativ klein sind. So bestehen die Proteinketten der Naturseide, die ausschließlich in der Faltblattstruktur angeordnet sind, zu 86 Prozent aus Gly, Ala und Ser, also Aminosäuren mit kleinen Resten. Ein weiteres Beispiel für Proteine mit überwiegender Faltblattstruktur sind Immunglobuline. Wenn die Aminosäure-Reste groß sind, ordnet sich die Polypeptidkette bevorzugt als α-Helix an.
Darstellung
- Bänderdiagramm
-
- In Proteinstrukturen werden β-Faltblätter oft als Pfeile dargestellt. Ein Pfeil entspricht einem Strang des Faltblattes. Mehrere Pfeile zusammen, die über Turns oder Loops verknüpft sind, bilden erst die Faltblattstruktur. Die Pfeile zeigen dabei in Richtung des Carboxyl-Terminus, um die Struktur des Faltblattes wiederzugeben.
- Kalottendarstellung und Kugelstabmodell
-
- Oft werden bei der Darstellung die Wasserstoffatome weggelassen, da sich die Positionen dieser Atome nicht leicht bestimmen lassen und ansonsten die Übersichtlichkeit leiden würde.
- Rückgratmodell
-
- Es werden meist nur die α-C-Atome dargestellt. Dadurch wird der Verlauf der Polypeptidkette viel besser dargestellt als beim Kalotten- oder Kugelstabmodell. Elemente der Sekundärstruktur sind jedoch trotzdem nicht sehr gut erkennbar.
Andere wichtige Strukturelemente
Andere Motive der Sekundärstruktur sind, außer der α-Helix und dem β-Faltblatt, drei verschiedene Arten von Schleifen (z. B. β-Schleife). Die nicht zu einem Motiv gehörenden Teile der Primärstruktur eines Proteins nennt man Zufallsschleifen (Random-Coil-Strukturen). Diese Strukturen sind maßgeblich an der Ausbildung der gesamten Proteinstruktur beteiligt.
Literatur
- Jeremy M. Berg: Stryer Biochemie. Spektrum Akademie Verlag, München 2007, ISBN 978-3-8274-1800-5
Siehe auch
Wikimedia Foundation.