- Buta-1,3-dien
-
Strukturformel 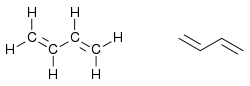
Allgemeines Name 1,3-Butadien Andere Namen - 1,3-Butadien
- Pyrrolylen
- Buta-1,3-dien – Butadien-1,3
- Biethylen – Diethylen – Diethen
- Bivinyl – Divinyl
- Vinylethylen – Vinylethen
- Erythren
Summenformel C4H6 CAS-Nummer 106-99-0 Kurzbeschreibung farbloses Gas mit aromatischem Geruch [1] Eigenschaften Molare Masse 54,09 g·mol−1 Aggregatzustand gasförmig
Dichte 2,4982 kg·m−3 (0 °C) [1]
Schmelzpunkt −108,92 °C [1]
Siedepunkt −4,5 °C [1]
Dampfdruck Löslichkeit wenig löslich in Wasser: 1 g·l−1 (20 °C) [1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Hoch-
entzündlichGiftig (F+) (T) R- und S-Sätze R: 45-46-12 S: 53-45 WGK 2 – wassergefährdend Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 1,3-Butadien (Vinylethylen) ist ein farbloses Gas mit mildem, aromatischen Geruch. Es ist ein ungesättigter Kohlenwasserstoff, von dem zwei Isomere existieren: 1,3-Butadien (von großer industrieller Bedeutung) und das schwieriger herzustellende und weit weniger bedeutende 1,2-Butadien.
Isopren (2-Methyl-1,3-butadien) ist ein Derivat des Butadiens.
Inhaltsverzeichnis
Eigenschaften
Die Geruchschwelle von Butadien liegt bei 4 mg/m3. Das Gas lässt sich leicht verflüssigen. In Wasser ist das Gas nur sehr gering löslich (1,03 g/l bei 20 °C). Butadien ist schwerer als Luft.
Butadien ist brennbar und polymerisiert leicht, deswegen wird ihm meist ein Stabilisator, zum Beispiel 4-tert-Butylbrenzcatechin (TBC) beigefügt.
Konjugierte Doppelbindungen beim 1,3-Butadien
Im planar gebauten Molekül sind alle vier Kohlenstoffatome sp2-Hybridisiert. Die π-Orbitale überlappen sich ober- und unterhalb der Molekülebene. π-Bindungen entstehen durch Überlappung bei dem 1. und 2. Kohlenstoffatom sowie dem 3. und 4. Kohlenstoffatom. Zusätzlich können aber die Orbitale des 2. und des 3. Kohlenstoffatoms überlappen, so dass sich die π-Elektronen über das ganze Molekül ausbreiten können. Die Elektronen sind delokalisiert. Dadurch, dass sich Elektronen auf einem größeren Raum verteilen, wird im 1,3-Butadien eine erhöhte Stabilität beobachtet. Der Einfluss dieser konjugierten Doppelbindungen zeigt sich bei Polymerisationsreaktionen mit Butadien: Erfolgt der Angriff am 1. Kohlenstoffatom, so wird nicht am mit dem 2. Kohlenstoff weiter verknüpft sondern mit dem vierten. Dafür bildet sich zwischen dem 2. und dem dritten Atom eine „neue“ Doppelbindung.
Herstellung
Butadien wird durch Wasserstoffabspaltung aus gesättigten Kohlenwasserstoffen durch starkes Erhitzen (Cracken) hergestellt.
Verwendung
Mehr als 90 Prozent der Produktion von Butadien wird zu Synthesekautschuk weiterverarbeitet. Eine weitere Anwendung ist ABS, ein Copolymerisat aus Acrylnitril, Butadien und Styrol. Außerdem wird aus Butadien und Blausäure Adiponitril hergestellt, das ein Zwischenprodukt in der Produktion von Polyamiden ist. Aus Butadien werden Hydroxyl-terminierte Polybutadiene (HTPB) hergestellt, die als gummiartige Feststoffe als Brennstoff in Hybridraketen dienen.
Historisches
Das aus Butadien und dem Katalysator Natrium produzierte Polymer Buna (ButadienNatrium) hatte große Bedeutung für die deutsche Rüstungs- und Kriegswirtschaft vor und während des Zweiten Weltkrieges.
Gefahren
Butadien ist krebserregend, hochentzündlich und giftig. Zwischen einem Luftvolumenanteil von 1,4 bis 16,3 Prozent bildet es explosive Gemische. Butadien wirkt narkotisierend.
Quellen
- ↑ a b c d e f Eintrag zu Butadien in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 9. Dez. 2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 106-99-0 im European chemical Substances Information System ESIS
Weblinks
Wikimedia Foundation.
