- Aliphatische Kohlenwasserstoffe
-
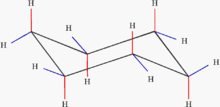
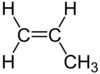
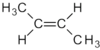
Aliphatische Kohlenwasserstoffe (griech. aleiphar, ‚fettig‘) sind organische chemische Verbindungen, die aus Kohlenstoff und Wasserstoff zusammengesetzt und nicht aromatisch sind. Damit sind sie eine Untergruppe der Kohlenwasserstoffe. Laut IUPAC sind aliphatische Verbindungen „acyclische oder cyclische, gesättigte oder ungesättigte Kohlenstoffverbindungen, außer aromatischen Verbindungen“.[1] Die einfachste Gruppe aliphatischer Kohlenwasserstoffe sind die gesättigten Alkane; weiterhin zählen die ebenfalls gesättigten Cycloalkane sowie die ungesättigten Kohlenwasserstoffe der Alkene und Alkine zur Gruppe der Aliphaten.
Wie alle reinen Kohlenwasserstoffe sind aliphatische Kohlenwasserstoffe unpolare, lipophile Verbindungen (also nicht wasserlöslich). Da laut IUPAC-Definition aliphatische Verbindungen den aromatischen Kohlenstoffverbindungen gegenübergestellt und damit durch eine Negation definiert werden, bedeutet dies im Umkehrschluss, dass alle organischen Verbindungen, die nicht aromatisch sind, aliphatisch sind. Die Klassifizierung organischer Verbindungen in Aliphaten und Aromaten erfolgt durch die Aromatizitätskriterien. Die sogenannten alicyclischen Verbindungen bilden eine Untergruppe der Aliphaten und zeichnen sich – ähnlich den Aromaten – durch ringförmige Ketten aus, werden aber durch die Aromatizitätskriterien von den Aromaten unterschieden.
Inhaltsverzeichnis
Exemplarische aliphatische Verbindungen
Die wichtigsten Stoffgruppen aliphatischer Verbindungen gemäß oben genannter Definition sind also:
- n-, Iso- und Cyclo-Alkane (gesättigte Kohlenwasserstoffe)
- n-, Iso- und Cyclo-Alkene und -Alkine (ungesättigte Kohlenwasserstoffe).
Wichtige Beispiele niedermolekularer aliphatischer Verbindungen finden sich in folgender Tabelle (angeordnet nach steigender Anzahl an Kohlenstoff-Atomen):
Formel Name CAS-Nummer Strukturformel Stoffgruppe Synonyme CH4 Methan 74-82-8 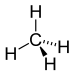
Alkan Methylwasserstoff C2H2 Ethin 74-86-2 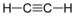
Alkin Äthin, Acetylen, Azetylen C2H4 Ethen 74-85-1 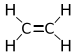
Alken Ethylen, Äthen, Äthylen, Elaylgas, Vinylwasserstoff, Etherin, Acetan, R 1150 C2H6 Ethan 74-84-0 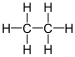
Alkan Äthan C3H4 Propin 74-99-7 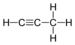
Alkin Methylacetylen, Allylen C3H6 Propen - Alken Propylen C3H8 Propan - 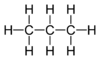
Alkan C4H6 1,2-Butadien 590-19-2 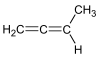
Dien Buta-1,2-dien, Methylallen C4H6 1-Butin - 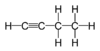
Alkin C4H8 Buten - z. B. Alken Butylen C4H10 n-Butan - 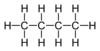
Alkan C6H10 Cyclohexen 110-83-8 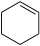
Cycloalken 1,2,3,4-Tetrahydrobenzol C5H12 N-Pentan 109-66-0 
Alkan Amylhydrid, n-Pentan C7H14 Cycloheptan 291-64-5 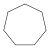
Cycloalkan C7H14 Methylcyclohexan 108-87-2 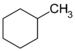
Cyclohexan C8H8 Cuban 277-10-1 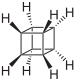
Cyclobutan Pentacyclo[4.2.0.02,5.03,8.04,7]octan C9H20 Nonan 111-84-2 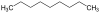
Alkan n-Nonan C10H12 Dicyclopentadien 77-73-6 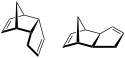
Dien, Cycloalken 3a,4,7,7a-Tetrahydro-4,7-methanoinden, Tricyclo(5.2.1.0(2,6))deca-3,8-dien, TCD, DCPD, dimeres Cyclopentadien C10H16 Phellandren 99-83-2 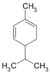
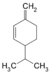
Terpen, Dien, Cycloalken α-Phellandren: 2-Methyl-5-(1-methylethyl)-1,3-cyclohexadien, β-Phellandren: 3-Methylene-6-(1-methylethyl)cyclohexen C10H16 α-Terpinen 99-86-5 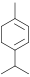
Terpen, Cycloalken, Dien Mentha-1,3-dien, 1-Isopropyl-4-methyl- 1,3-cyclohexadien C10H16 Limonen 5989-27-5 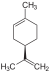
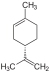
Terpen, Dien, Cycloalken 1-Methyl-4-prop-1-en-2-ylcyclohexen, Carven, p-Mentha-1,8-dien, 1-Methyl-4-isopropenyl-1-cyclohexen, 1-Methyl-4-(1-methylethenyl)cyclohexen, 4-Isopropenyl-1-methylcylohexen, Dipenten, Kautschin, Cinen, Cajeputene C11H24 Undecan 1120-21-4 
Alkan Undekan, n-Undecan, n-Undekan, Hendekan C30H50 Squalen 111-02-4 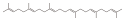
Terpen, Polyen 2,6,10,15,19,23-Hexamethyl-
2,6,10,14,18,22-tetracosahexaen, Spinacen, SupraenC2nH4n Polyethylen 9002-88-4 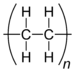
Alkan Polyethen, PE (Die hier zum Teil mitaufgeführte CAS-Registrierungsnummer ist ein geschütztes Warenzeichen der American Chemical Society).
Aliphatische Verbindungen in der Spektroskopie
Aliphatische C-H-Valenzschwingungen von nicht konjugierten C-H-Bausteinen in einem Molekül haben im IR-Spektrum im Bereich von 3000−2750 cm−1 charakteristische Peaks. Im Gegensatz dazu befinden sich die Peaks bei konjugierten C-H-Bausteinen jenseits der 3000 cm−1-Grenze.
Im 1H-NMR Spektrum befinden sich die meisten aliphatischen Peaks im Bereich von 1−2 ppm. Höhere Werte bis etwa 5 ppm werden bei benachbarten elektronenziehenden Gruppen erhalten.
Aliphatische Verbindungen in der Petrochemie
Hauptquelle der Gewinnung von aliphatischen Verbindungen ist das Erdöl. Das wichtigste Verfahren der Erdölaufbereitung ist das Steamcracken, bei dem u. a. Ethan, LPG, Naphtha und Gasöl oder andere geeignete Kohlenwasserstoffe gecrackt werden[2]. Die Gasphase der Steamcrackerprodukte enthält die aliphatischen Grundchemikalien Ethylen, Propylen, den C4-Schnitt (hauptsächlich Buten, Iso-Buten und 1,3-Butadien) sowie Isopren.
Die bedeutendsten aliphatischen Folgeprodukte hieraus werden aus den Stoffen Eth(yl)en, Prop(yl)en und But(yl)en hergestellt. Es sind:
- aus Ethylen:
- Polyethylen – z.B. über Ziegler-Natta-Verfahren
- ca. 21% der Gesamtethylenproduktion in LDPE
- ca. 13% als LLDPE
- ca. 23% als HDPE
- α-Olefine
- Poly-α-Olefine als Schmiermittel
- Co-Monomere für Polyethylen
- Polyethylen – z.B. über Ziegler-Natta-Verfahren
- aus Propylen:
- Polypropylen – z.B. durch Ziegler-Natta-Verfahren (ca. 57% der Gesamtpropylenproduktion)
- aus Buten:
- Monomere und Co-Monomere (Buten-Folgeprodukte in der Kunststoffherstellung)
- Isobuten – als Monomer für die Copolymerisation mit Isopren
- 1,3-Butadien - Monomer oder Co-Monomer für die Polymerisation zu Elastomeren
Quellen
Weblinks
Wikimedia Foundation.