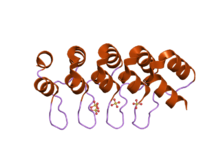- DARPins
-
DARPins (kurz von engl. Designed Ankyrin Repeat Proteins) sind künstliche Proteine, die zur Erkennung und Bindung von Antigenen befähigt sind. Sie sind strukturell von Ankyrin-Proteinen abgeleitet und bestehen aus mehreren Repeat-Motiven dieser Proteine. DARPins mit insgesamt vier Repeat-Motiven und einer Molekülmasse von etwa 14 kDa sind etwa 10 mal leichter als ein Antikörper vom IgG-Typ. Ihre Affinität zu einem Antigen ist mit der eines Antikörpers vergleichbar. DAPRins können sich als Agonisten, Antagonisten, inverse Agonisten oder Enzyminhibitoren verhalten.[1] DARPins wurden maßgeblich an der Universität Zürich entwickelt. Ein Einsatz als Werkzeuge in der Forschung sowie als Diagnostika und Therapeutika wird angestrebt.[2]
Inhaltsverzeichnis
Struktur
DARPins sind strukturell von Proteinen abgeleitet, die ein oder mehrere sogenannte Ankyrin-Repeat-Motive tragen. Dieses weit verbreitete, meist 33 Aminosäure-lange Motiv besteht aus einer β-Schleife und zwei α-Helices und kann nicht nur im Cytoskelett-Protein Ankyrin, sondern in großer Zahl in Proteinen fast aller Lebewesen gefunden werden.[3] DARPins tragen mindestens drei dieser Motive. Noch kleinere künstliche Repeat-Proteine mit nur einem oder zwei Repeat-Motiven bilden keine ausreichende Tertiärstruktur aus.[4] Als Antikörpermimetika werden insbesondere DARPins mit zwei oder drei variablen Repeat-Motiven, die von zwei endständigen konstanten Repeat-Motiven flankiert werden, entwickelt und eingesetzt.
Innerhalb der Repeat-Motive kann der gezielte Austausch einzelner Aminosäuren zu einer Affinitätssteigerung beitragen. Die oberflächennahen Aminosäuren in den Positionen 1, 3, 11, 12, 31 und 33 der jeweiligen Motive eignen sich für Modifikationen, da sie nicht für die Struktur der DARPins essenziell sind, aber mit einer Interaktion mit Zielproteinen in Verbindung gebracht werden.[5]
Eigenschaften
Wie andere Antikörpermimetika besitzen DARPins eine gegenüber den meisten Antikörpern erhöhte Temperaturstabilität. Eine Denaturierung von DARPins mit vier bis sechs Repeat-Motiven erfolgt erst bei Temperaturen oberhalb des Bereichs von 66 bis 85 °C.[6]
DARPins, die mit Hilfe gentechnischer Methoden in Zielzellen eingeschleust werden, eignen sich als alternative Werkzeuge zu Intrabodys und RNAi zur Untersuchung von Zellfunktionen und stellen eine Option in der Gentherapie dar.[7]
Herstellung
Mit Hilfe molekularbiologischer Methoden unter Anwendung der zufälligen Mutagenese werden Molekülbibliotheken von DARPins angelegt. Diese DARPin-Bibliotheken werden unter Einsatz geeigneter Displaytechniken, wie beispielsweise dem Phagendisplay oder dem Ribosomendisplay, DARPins selektiert, die das Zielprotein binden können. Nach einer Auswahl des geeignetsten DARPins lässt sich dieses mit einer sehr hohen Ausbeute mit Hilfe von Produktionsorganismen, wie beispielsweise E. coli, herstellen.[6]
Einzelnachweise
- ↑ Stumpp MT, Binz HK, Amstutz P: DARPins: a new generation of protein therapeutics. In: Drug Discov. Today. 13, Nr. 15-16, August 2008, S. 695–701. doi:10.1016/j.drudis.2008.04.013. PMID 18621567.
- ↑ Heinzelmann E (2008). DARPins - Allrounder für Diagnose und Therapie. Swiss Engineering 12/2008: 62-63.
- ↑ Bork P: Hundreds of ankyrin-like repeats in functionally diverse proteins: mobile modules that cross phyla horizontally?. In: Proteins. 17, Nr. 4, Dezember 1993, S. 363–74. doi:10.1002/prot.340170405. PMID 8108379.
- ↑ Mosavi LK, Minor DL, Peng ZY: Consensus-derived structural determinants of the ankyrin repeat motif. In: Proc. Natl. Acad. Sci. U.S.A.. 99, Nr. 25, Dezember 2002, S. 16029–34. doi:10.1073/pnas.252537899. PMID 12461176. Volltext bei PMC: 138559.
- ↑ Stumpp MT, Amstutz P: DARPins: a true alternative to antibodies. In: Curr Opin Drug Discov Devel. 10, Nr. 2, März 2007, S. 153–9. PMID 17436550.
- ↑ a b Binz HK, Stumpp MT, Forrer P, Amstutz P, Plückthun A: Designing repeat proteins: well-expressed, soluble and stable proteins from combinatorial libraries of consensus ankyrin repeat proteins. In: J. Mol. Biol.. 332, Nr. 2, September 2003, S. 489–503. PMID 12948497.
- ↑ Amstutz P, Binz HK, Parizek P, et al.: Intracellular kinase inhibitors selected from combinatorial libraries of designed ankyrin repeat proteins. In: J. Biol. Chem.. 280, Nr. 26, Juli 2005, S. 24715–22. doi:10.1074/jbc.M501746200. PMID 15851475.
Literatur
- Forrer P, Binz HK, Stumpp MT, Plückthun A: Consensus design of repeat proteins. In: Chembiochem. 5, Nr. 2, Februar 2004, S. 183–9. doi:10.1002/cbic.200300762. PMID 14760739.
- Stumpp MT, Amstutz P: DARPins: a true alternative to antibodies. In: Curr Opin Drug Discov Devel. 10, Nr. 2, März 2007, S. 153–9. PMID 17436550.
- Stumpp MT, Binz HK, Amstutz P: DARPins: a new generation of protein therapeutics. In: Drug Discov. Today. 13, Nr. 15-16, August 2008, S. 695–701. doi:10.1016/j.drudis.2008.04.013. PMID 18621567.
Wikimedia Foundation.