- Chemische Gleichung
-
In der Chemie ist eine Reaktionsgleichung – auch Reaktionsschema genannt – die Kurzschreibweise für eine chemische Reaktion. Sie gibt die Ausgangs- und Endstoffe einer Stoffumwandlung in Formelschreibweise wieder, ist international einheitlich und wird von allen Chemikern verstanden. Da Ausgangs- und Endstoffe jedoch bei einer Stoffumwandlung eben nicht gleich sind, ist der fachlich korrektere Ausdruck Reaktionsschema zu bevorzugen. Dieser Artikel beschreibt daher diesen grundlegenden Fachbegriff der Chemie und die entsprechende Formelsprache fachwissenschaftlich näher, während im Artikel Reaktionsschema die Regeln erläutert werden, nach denen in der Formelsprache der Chemie ein solches Reaktionsschema (eine solche Reaktions- bzw. chemische Gleichung) formal korrekt erstellt wird.
Sind die Beträge der stöchiometrischen Koeffizienten in der Gleichung ganzzahlig und möglichst klein, spricht man nach der DIN 32642 von einer Kardinalgleichung.
Inhaltsverzeichnis
Aufbau einer Reaktionsgleichung
Der Aufbau einer Reaktionsgleichung (eines Reaktionsschemas) folgt in der Chemie bestimmten Regeln, deren Anwendung beim Erstellen im Artikel Reaktionsschema ausführlich erläutert wird. Zusammengefasst ist zu sagen:
Auf der linken Seite stehen die chemischen Summenformeln der Ausgangsstoffe (Edukte) – auf der rechten die Summenformeln der Produkte. Dazwischen wird ein Reaktionspfeil geschrieben (z. B.
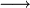 ), der kennzeichnet, in welche Richtung die Reaktion abläuft. Vor die Formeln setzt man zudem groß geschriebene Zahlen. Diese stöchiometrischen Koeffizienten der beteiligten Stoffen geben an, wie viele Moleküle des jeweiligen Stoffes oder wie viel Stoffmenge (in Mol) jeweils benötigt, verbraucht oder erzeugt werden. Sie müssen so gewählt werden, dass die Stoffmengen-Verhältnisse der Reaktionspartner (ihre stöchiometrischen Bedingungen) korrekt wiedergegeben werden: Für jedes chemische Element müssen auf der linken Seite einer Reaktionsgleichung gleich viele Atome wie auf der rechten Seite vorhanden sein (Die Ziffer „Eins“ als stöchiometrischer Koeffizient taucht daher z. B. nicht als Faktor auf). Diese „stöchiometrischen Koeffizienten“ werden in DIN 32642 stöchiometrischen Zahlen genannt.
), der kennzeichnet, in welche Richtung die Reaktion abläuft. Vor die Formeln setzt man zudem groß geschriebene Zahlen. Diese stöchiometrischen Koeffizienten der beteiligten Stoffen geben an, wie viele Moleküle des jeweiligen Stoffes oder wie viel Stoffmenge (in Mol) jeweils benötigt, verbraucht oder erzeugt werden. Sie müssen so gewählt werden, dass die Stoffmengen-Verhältnisse der Reaktionspartner (ihre stöchiometrischen Bedingungen) korrekt wiedergegeben werden: Für jedes chemische Element müssen auf der linken Seite einer Reaktionsgleichung gleich viele Atome wie auf der rechten Seite vorhanden sein (Die Ziffer „Eins“ als stöchiometrischer Koeffizient taucht daher z. B. nicht als Faktor auf). Diese „stöchiometrischen Koeffizienten“ werden in DIN 32642 stöchiometrischen Zahlen genannt.Beispielsweise wird die Verbrennung von Methangas (Formel: CH4) und Sauerstoffgas (Formel: 2 O2) zu Kohlenstoffdioxid und Wasser durch die Gleichung
beschrieben. In diesem Beispiel sind für Kohlenstoff C je ein Atom (links in CH4 und rechts in CO2), für Wasserstoff H je vier Atome (links in CH4 und rechts je 2 in beiden H2O), sowie für Sauerstoff O ebenfalls je vier Atome (links je zwei in beiden O2 und rechts zwei in CO2 und je eines in beiden H2O) vorhanden.
Mögliche Zusatzangaben in Reaktionsgleichungen
Zur Verdeutlichung werden, sofern nicht für den betrachtenden Fall unerheblich, die Phasen der Reaktanden in Kurzbeschreibung im Reaktionsschema mit angegeben.
Über den Pfeil schreibt man gegebenenfalls die Reaktionsbedingungen, wie z.B. das Zuführen von Aktivierungsenergie. Die entstehende oder aufgewendete Reaktionsenergie wird auf die Seite geschrieben, wo sie anfällt bzw. aufgewendet werden muss.
Für thermodynamische Berechnungen wird häufig die Reaktionsenthalpie mit angegeben, beispielsweise bei der Reaktionsgleichung der Knallgasreaktion
Bei der Bildung von einem Mol flüssigem (eng.: liquid) H2O aus gasförmigen H2 und O2 werden also 286 kJ Energie frei. Hier ist es wesentlich, dass die Phase der an der Reaktion beteiligten Substanzen mitangegeben wird, da bei den Phasenübergängen ebenfalls Energie umgesetzt wird. Die Reaktionswärme ΔH wird üblicherweise bei 25 °C angegeben. Ein positiver Wert von ΔH bezeichnet endotherme Reaktionen, ein negativer Wert exotherme Reaktionen.
In der Chemie werden in Reaktionsgleichungen verschiedene Pfeile verwendet, deren Bedeutung genau festgelegt ist:
- Reaktionspfeil (→)
- Gleichgewichtspfeil (
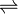 )
) - Mesomeriepfeil (↔)
- Retrosynthesepfeil (
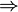 )
)
Erstellen einer Reaktionsgleichung
Anhand der Reaktion von Wasserstoffgas (H2) und Sauerstoffgas (O2) zu Wasser (H2O) soll das Erstellen einer Reaktionsgleichung geschildert werden.
Deutung erstellen
Durch die Beobachtung kann man die Endstoffe für eine Reaktionsgleichung erstellen. Wir wissen, dass ein neuer Stoff entsteht. Dieser Stoff kann nicht Wasserstoff oder Sauerstoff sein. Der neue Stoff muss also eine Verbindung aus einem Wasserstoff und Sauerstoff-Atom sein. Wir haben also:
Stöchiometrische Wertigkeiten aufschreiben
H2 und O2 haben die Wertigkeit 0, da diese Moleküle nur aus einer Atomsorte bestehen. In HO hat H die Wertigkeit +I und O hat die Wertigkeit −II. Nun müssen wir die Atomzahlen von H und O für das Produkt errechnen. Wir bilden das kleinste gemeinsame Vielfache der Wertigkeiten:
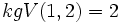 .
.
Nun ist die Atomzahl dieses kgV dividiert durch die Wertigkeit des Elements. Für H:
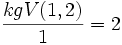 .
.
Und für O ist die Atomzahl:
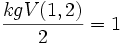 .
.
Das Produkt muss also H2O lauten. Zum Nachprüfen schaut man, ob das Molekül insgesamt auf eine Wertigkeit von 0 kommt:
Die Reaktionsgleichung lautet nun:
Ermitteln der Faktoren
In der letzten Gleichung wären unter den Edukten zwei Wasserstoffatome (1 H2) und zwei Sauerstoffatome (1 O2), im Reaktionsprodukt sind es aber zwei Wasserstoffatome (1 H2) und ein Sauerstoffatom (1 O). Man muss also vor das Reaktionsprodukt eine 2 schreiben:
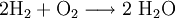 .
.
Nun sind es aber bei den Edukten zwei Wasserstoffatome zu wenig, also muss man vor H2 ebenfalls eine 2 schreiben.
Ladungen ausgleichen
Bei manchen Reaktionsgleichungen muss man nun die Ladungen ergänzen. Wir fügen zur Ausgangsseite H+ oder (OH)− hinzu, damit wir auf beiden Reaktionsgleichungen die gleiche Ladung haben.
Beispiel: Ausgangsseite hat die Ladung +1 und Endseite hat die Ladung +2, dann müssen wir
hinzufügen.
Wenn die Ausgangsseite die Ladung +2 und Endseite die Ladung +1 hat, dann müssen wir
hinzufügen. Diese Ionen reagieren dann mit den übrigbleibenden H+ oder (OH)− zu H2O.
Ergebnis
Die Reaktionsgleichung lautet nun:
Weitere Gleichungen
An Stelle der Vollschreibweise mit kompletten Summenformeln kann man nicht mitreagierende Kationen oder Anionen auch aus der Reaktionsgleichung herauskürzen. Auf diese Weise erstellte Reaktionsgleichungen lauten z. B.:
Nutzen von Reaktionsgleichungen: Umsatzberechnungen
Um den Stoffumsatz bei einer Reaktion zu berechnen, wird die Reaktionsgleichung mit Hilfe von Stoffmengen-Angaben in Mol benutzt. Grundlagen dieser Rechenmethode finden sich im Artikel Stöchiometrie (Fachrechnen Chemie). Als Beispiel wird hier kurz die oben beschriebene Reaktionsgleichung der Verbrennung von Methangas genommen. Das Reaktionsschema lautet:
Es besagt qualitativ: Methan und Sauerstoff reagieren zu Kohlendioxid und Wasser.
Es besagt quantitativ: 1 Mol Methangas und 2 Mol Sauerstoff ergeben 1 Mol Kohlendioxid + 2 Mol Wasserdampf.
Da 1 Mol Gas unter Normalbedingungen 22,4 L Raum einnimmt, besagt es auch:
- 22,4 L Methan + 44,8 L Sauerstoff ergeben 22,4 L Kohlendioxid + 44,8 L Wasserdampf.
Da 1 Mol C 12 g wiegt, 1 Mol Methan 16 g, 1 Mol Sauerstoff 32 g, 1 Mol Wasser 18 g und 1 Mol Kohlendioxid 44 g, so besagt es auch:
- 16 g Methan + 64 g Sauerstoff ergeben 44 g Kohlendioxid + 36 g Wasserdampf.
Es liegen also je 80 g Ausgangsstoffe (Edukte) und 80 g Endstoffe (Produkte) vor. Aus je 16 g Methangas (22,4 L) werden 44 g Kohlendioxid.
Ähnliche Umsatzberechnungen sind für jede andere chemische Reaktion möglich, deren Reaktionsschema erstellt worden ist. So lassen sich erforderliche Rohstoffmengen oder theoretisch erzielbare Produktmengen (bei 100%iger Ausbeute) über Reaktionsschemen und Molare Massen berechnen. Für die Beispielaufgabe Wie viel Wasserstoff entsteht bei der Reaktion von 1 g Lithium mit Wasser? findet sich ein solches Beispiel im Artikel zur Stöchiometrie.
Weblinks
- Online Rechner zum Bestimmen der Koeffizienten einer stöchiometrischen Gleichung, inklusive der Beschreibung des mathematischen Hintergrunds
- Netchemie Formelmaker - Struktur- und Reaktionsgleichungen einfach aufstellen
Literatur
- Michael Wächter: Stoffe, Teilchen, Reaktionen. Verlag Handwerk und Technik, Hamburg 2000, S. 154–169, ISBN 3-582-01235-2
Wikimedia Foundation.

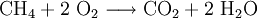
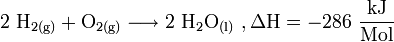
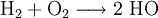
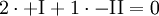
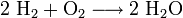
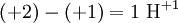
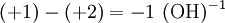
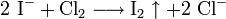
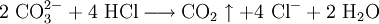
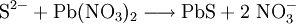
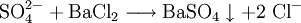
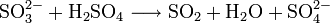
![\mathrm{4 \ Fe^{3+} + 3 \ K_4[Fe(CN)_6] (aq) \longrightarrow Fe_4[Fe(CN)_6]_3 + 12 \ K^+}](/pictures/dewiki/54/61371152d24377ded02f714e5c2233f9.png)