- Vanillin-Dehydrogenase
-
Vanillin-Dehydrogenase —
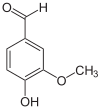
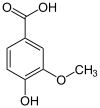
Masse/Länge Primärstruktur 482 Aminosäuren (in Pseudomonas putida Stamm KT2440) Kofaktor NAD+ Bezeichner Externe IDs UniProt: Q88HJ9 CAS-Nummer: 189767-93-9 Enzymklassifikation EC, Kategorie 1.2.1.67 Oxidoreduktase Substrat Vanillin, H2O Produkte Vanillinsäure, 2 H+ Vorkommen Übergeordnetes Taxon Pseudomonas Eine Vanillin-Dehydrogenase (VDH, EC 1.2.1.67) ist ein Enzym, das die Umsetzung von Vanillin zur Vanillinsäure katalysiert. Die Dehydrogenase gehört zur Familie der Oxidoreduktasen.
Für die Reaktion wird als Cofaktor NAD+ benötigt, das zu NADH reduziert wird:
Das Enzym wurde unter anderem in Pseudomonas putida sowie Pseudomonas fluorescens nachgewiesen. Dort ist Vanillin ein Zwischenprodukt beim Abbau von Ferulasäure zu Protocatechusäure, welche dann nach Ringspaltung weiter metabolisiert wird.[1][2]
Das Fehlen des Cofaktors NAD+ reduziert die enzymatische Aktivität in P. fluorescens.[1]
Homologe Enzyme wurden auch bei Burkholderia-Arten gefunden und gehören allgemein zu den Aldehyddehydrogenasen.[3]
Einzelnachweise
- ↑ a b Narbad, A. und Gasson, MJ.: Metabolism of ferulic acid via vanillin using a novel CoA-dependent pathway in a newly-isolated strain of Pseudomonas fluorescens, in: Microbiology 1998, 144 (Pt 5), S. 1397–1405; PMID 9611814; PDF (freier Volltextzugriff, engl.)
- ↑ Plaggenborg R, Overhage J, Steinbüchel A, Priefert H.: Functional analyses of genes involved in the metabolism of ferulic acid in Pseudomonas putida KT2440, in: Appl Microbiol Biotechnol 2003 61 (5–6), S. 528–535; PMID 12764569; doi:10.1007/s00253-003-1260-4.
- ↑ Homologe bei OMA
Wikimedia Foundation.