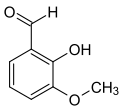
- Vanillin
-
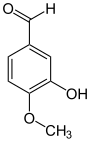
Strukturformel 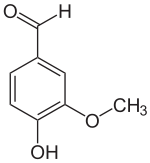
Allgemeines Name Vanillin Andere Namen - 4-Hydroxy-3-methoxybenzaldehyd
- FEMA 3107
- Vanillaldehyd
- Vanillinum
Summenformel C8H8O3 CAS-Nummer 121-33-5 PubChem 1183 Kurzbeschreibung farblose, nach Vanille riechende Nadeln[1]
Eigenschaften Molare Masse 152,15 g·mol−1 Aggregatzustand fest
Dichte 1,06 g·cm−3[2]
Schmelzpunkt Siedepunkt pKs-Wert Löslichkeit - schlecht in Wasser (10 g·l−1 bei 20 °C)[2]
- gut in Ethanol und Diethylether[1]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [2] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Vanillin (4-Hydroxy-3-methoxybenzaldehyd, FEMA 3107) ist der Hauptaromastoff in den Kapselfrüchten der Gewürzvanille (Vanilla planifolia) sowie ein naturidentischer Aromastoff. Es ist eine organische chemische Verbindung mit der Summenformel C8H8O3. Es ist ein substituiertes Derivat des Benzaldehyds mit einer zusätzlichen Hydroxy- und einer Methoxygruppe.
Vanillin ist der Hauptbestandteil des natürlichen Vanilleextrakts, einer Mischung aus mehreren hundert verschiedenen Verbindungen. Aufgrund der Knappheit und Kosten des natürlichen Vanilleextrakts gibt es seit langem synthetische Herstellungsverfahren für Vanillin. Die erste kommerzielle Synthese von Vanillin begann mit dem leichter verfügbaren Naturstoff Eugenol. Heute wird Vanillin entweder aus Guajacol synthetisiert oder aus Lignin gewonnen, einem Bestandteil von Holz und Nebenprodukt der Papierindustrie.
Vanillin ist mengenmäßig der wichtigste Aromastoff weltweit, da er preisgünstig hergestellt werden kann. Er wird in Lebensmitteln, Getränken, Speiseeis, Backwaren und Schokolade, sowie in der Parfüm- und Pharmaindustrie verwendet. Auch der typische Geruch von altem Papier ist unter anderem auf das Vanillin im Lignin zurückzuführen.
Inhaltsverzeichnis
Geschichte
Vanille wurde als Aroma von präkolumbianischen Völkern Mittelamerikas angebaut; zum Zeitpunkt ihrer Eroberung durch Hernán Cortés benutzten die Azteken es als Aromastoff für Schokolade. Den Europäern wurde sowohl Schokolade als auch Vanille um das Jahr 1520 bekannt.[5]
Vanillin wurde erstmals im Jahre 1858 als relativ reine Substanz von Nicolas-Theodore Gobley isoliert, dies geschah durch vollständiges Eindampfen eines Vanilleextrakts und anschließendes Umkristallisieren aus heißem Wasser.[6] Im Jahr 1874 gelang erstmals dem Chemiker Wilhelm Haarmann zusammen mit Ferdinand Tiemann in Holzminden die Herstellung von Vanillin aus Coniferin, das im Rindensaft von Nadelhölzern (Coniferen) vorkommt.[7]
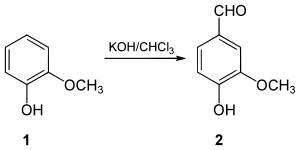
1876 synthetisierte Karl Ludwig Reimer erstmals aus Guajacol (1) das Vanillin (2).[8] In der später als Reimer-Tiemann-Reaktion benannten Synthese wird Guajacol im Alkalischen mit Chloroform umgesetzt. Dabei reagiert zuerst Chloroform mit der Base zu Dichlorcarben. Dieses lagert sich am Phenolat-Anion des Guajacols an.
Vorkommen
Vanillin findet sich am häufigsten in den meist falsch als Schoten bezeichneten Kapselfrüchten der Gewürzvanille (Vanilla planifolia) (1,5–4 %), ferner auch in Styrax, Gewürznelken und anderen Pflanzen.[1] Die frisch geernteten grünen Samenkapseln enthalten Vanillin in Form seines β-D-Glucosids Vanillosid[9], die grünen Hülsen besitzen nicht den Geschmack oder Geruch von Vanille.[10] Relativ reines Vanillin kann sich als weißer Staub oder „Frost“ auf der Außenseite der Hülsen abscheiden.
In niedrigeren Konzentrationen trägt Vanillin zum Geschmack und Aroma von Lebensmitteln in vielfältiger Weise bei: in Olivenöl[11], Butter[12], Himbeeren[13] und Lychee-Früchten[14]. Bei der Reifung von Weinen und Spirituosen in Eichenfässern trägt Vanillin gleichfalls zum Geschmacksprofil bei.[15] In anderen Lebensmitteln entsteht durch Wärmebehandlung Vanillin aus anderen vorhandenen Inhaltsstoffen. Auf diese Weise trägt Vanillin zum Geschmack und Aroma von geröstetem Kaffee bei[16][17], ferner in Ahornsirup[18] und Vollkornprodukten, einschließlich Mais-Tortillas[19] und Haferflocken[20].
Biosynthese
Vanillin ist ein Produkt des Shikimisäurewegs (1). Endprodukte dieses Wegs chemischer Reaktionen sind die Aminosäuren Phenylalanin, Tyrosin und Tryptophan. Phenylalanin (2) wird biosynthetisch mit Hilfe des Enzyms Phenylalanin-Ammoniak-Lyase (PAL) unter Freisetzung von Ammoniak (NH3) zu Zimtsäure (3) umgesetzt. Dies ist der erste Schritt in der Biosynthese der Phenylpropanoide.[21][22][23]
Zwei wesentliche Wege sind in Diskussion, wie auf Basis von Phenylpropanoidverbindungen die Schritte zum Vanillin verlaufen: der Ferulasäureweg und der Benzoatweg. Beide gehen zunächst von einer p-Hydroxylierung der Zimtsäure zur p-Cumarsäure (4-Hydroxyzimtsäure) (4) aus. Danach folgen drei Reaktionschritte, deren Reihenfolge unterschiedlich ist, aber letztlich zum Zielmolekül führen.
- Im Ferulasäureweg erfolgt zunächst eine Hydroxylierung an der 3-Position im Ring zur Kaffeesäure (5) und anschließend deren Methylierung zur Ferulasäure (6), schließlich die Spaltung der Doppelbindung zum Aldehyd, dem Vanillin (7).
- Im Benzoatweg erfolgt hingegen zuerst die Spaltung der Doppelbindung zum 4-Hydroxybenzaldehyd (8), anschließend die Hydroxylierung an der 3-Position im Ring zum Protocatechualdehyd (9) und schließlich deren Methylierung zum Vanillin (7).
Die Hydroxylierungen von 3 nach 4 und von 8 nach 9 werden vom Enzym Diphenolase katalysiert. Die Diphenolase wirkt bei letzterer Reaktion als Monophenoloxidase; diese Aktivität hat momentan eine unterschiedliche EC-Nummer (EC 1.14.18.1), es handelt sich aber um dasselbe Enzym.[24]
Gewinnung und Darstellung
Natürliche Quellen
Die bis zu 30 cm langen Kapselfrüchte der Gewürzvanille werden kurz vor der Reife geerntet. Diese haben noch nicht das typische Aroma und den Geschmack des fertigen Produkts. Zur Gewinnung werden die Früchte der sogenannten Schwarzbräunung unterzogen. Zuerst werden die Kapselfrüchte heißwasser- oder wasserdampfbehandelt, anschließend folgt eine Fermentation in luftdichten Behältern. Durch die Trocknungs- und Fermentierungsprozesse wandeln sich die β-D-Glucoside des Vanillins in Vanillin und Glucose um.
Ein Großteil des Vanillins wird aus den bei der Papierherstellung anfallenden Sulfitabfällen gewonnen. Die hierin enthaltene Ligninsulfonsäure wird bei erhöhter Temperatur und erhöhtem Druck mit Oxidantien und Alkalien behandelt, wobei unter anderem Vanillin entsteht, das durch Extraktion, Destillation und Kristallisation gereinigt wird.[25][26] Die Ausbeuten betragen je nach Holzart 7–25 %.[27] Dieses künstliche Vanille-Aroma auf Lignin-Basis besitzt ein reicheres Geschmacksprofil. Dies ist auf die Anwesenheit von Acetovanillon als Lignin-Folgeprodukt zurückzuführen – eine Verunreinigung, die in Vanillin aus einer Guajacolsynthese nicht auftritt.[5]
Technische Synthesen
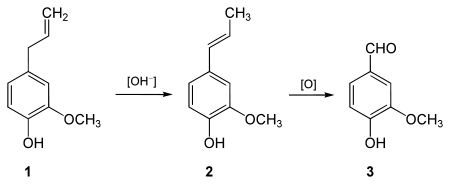
- Vanillin lässt sich technisch durch Isomerisierung von Eugenol (1) zu Isoeugenol (2) mittels Alkalien und anschließender Oxidation durch Kaliumpermanganat oder Ozon gewinnen.[26][27]
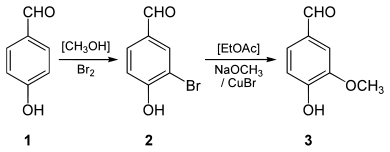
- Eine Synthese im Labormaßstab erfolgt durch eine elektrophile Bromierung von 4-Hydroxybenzaldehyd (1) zum 3-Brom-4-hydroxybenzaldehyd (2), gefolgt von einer Kupfer-katalysierten Methoxylierung zum Vanillin (3):[28]
- Mittels der Vilsmeyer-Haack-Synthese erhält man Vanillin aus Guajacol in etwa 70%iger Ausbeute.[27]
- Guajacol lässt sich mit Formaldehyd und 3-Nitrobenzolsulfonsäure in einem mehrere Tage dauernden Prozess zu Vanillin und Metanilsäure umwandeln.
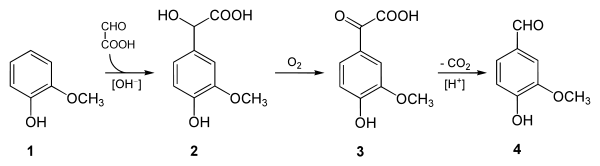
- Eine weitere Möglichkeit ist die Substitutionsreaktion von Guajacol (1) mit Glyoxylsäure und anschließende Oxidation der gebildeten Vanillinmandelsäure (2) zu 4-Hydroxy-3-methoxyphenylglyoxylsäure (3), die zu Vanillin (4) decarboxyliert wird.[5]
Biotechnologische Methoden
Alternativ stehen auch biotechnologische Methoden zur Verfügung.[29][30] Vanillin kann beispielsweise durch Amycolatopsis- oder Streptomyces-Stämme aus Ferulasäure hergestellt werden. Die Ferulasäure kann ebenfalls biotechnologisch mit Hilfe von Pseudomonas-Stämmen aus Eugenol im Fed-Batch-Verfahren (Eugenol ist toxisch für die Zellen) hergestellt werden. Eugenol ist ein gut verfügbarer Rohstoff und stammt aus Nelkenöl. Im Gegensatz zur chemischen Herstellung („naturidentisch“) darf das biotechnologisch hergestellte Vanillin als „natürlich“ deklariert werden.
Eigenschaften
Physikalische Eigenschaften
Vanillin tritt in Form farbloser, nach Vanille riechender Nadeln auf, die an feuchter Luft allmählich zu Vanillinsäure oxidieren.[1] Es löst sich schlecht in Wasser (10 g/l bei 20 °C)[2], hingegen gut in Ethanol und Diethylether.[1] Es schmilzt bei 82 °C[2] und siedet bei 285 °C bei Normaldruck in einer CO2-Atmosphäre[1] bzw. 154 °C bei Unterdruck (13 hPa).[2]
Chemische Eigenschaften
Die Substanz leitet sich strukturell sowohl vom Benzaldehyd als auch vom Guajacol (2-Methoxyphenol) ab. Infolge seines bifunktionalen Charakters ist Vanillin sehr reaktionsfreudig. Durch Veretherung, Veresterung oder Aldolkondensation sind sehr viele Derivate synthetisierbar. Durch Angriff am aromatischen Ring sind weitere Reaktionen möglich. Eine katalytische Hydrierung von Vanillin führt zu Vanillylalkohol bzw. zu 2-Methoxy-4-methylphenol.[31] Vanillin kann enzymatisch zur Vanillinsäure oxidiert werden.[32] Eine wässrige Lösung von Eisen(III)-chlorid bildet mit Vanillin eine blauviolette Färbung.[1]
Der pKs-Wert der phenolischen OH-Gruppe beträgt 7,40 (25 °C).[1][3] Dieser Wert ist gegenüber dem Phenol mit 9,99[3] deutlich niedriger; die elektronenziehende Aldehydgruppe erhöht durch ihren −M-Effekt die OH-Acidität; die phenolische OH-Bindung wird zunehmend polarisiert. Der pKs-Wert des 4-Hydroxybenzaldehyds bewegt sich bei einem ähnlichen Wert und beträgt 7,66[3]; die fehlende Methoxygruppe macht hier kaum einen Unterschied aus; auch das Guajacol (2-Methoxyphenol) besitzt mit seinem pKs-Wert von 9,98[3] praktisch keinen Unterschied zum Phenol.
Isomere und strukturelle Verwandte
Isovanillin (3-Hydroxy-4-methoxybenzaldehyd) ist ein Isomer und unterscheidet sich vom Vanillin durch die Stellung der Methoxygruppe. Anstatt an Position 3 ist diese hier an Position 4 vorzufinden. Hydroxy- und Methoxygruppe tauschen im Vergleich zum Vanillin die Plätze.
ortho-Vanillin (2-Hydroxy-3-methoxybenzaldehyd) ist gleichfalls ein Isomer und unterscheidet sich vom Vanillin durch die Stellung der Hydroxygruppe. Die Vorsilbe ortho- kennzeichnet hier die Position der Hydroxygruppe in Bezug zur Aldehydgruppe; im Vanillin befinden sich diese beiden Gruppen in para-Stellung.
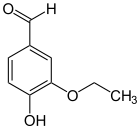
Ethylvanillin (4-Hydroxy-3-ethoxybenzaldehyd) ist ein struktureller Verwandter und unterscheidet sich vom Vanillin, indem man die Methylgruppe gegen eine Ethylgruppe austauscht. Es kommt nicht natürlich vor, sondern wird auf dem Syntheseweg hergestellt. Heute wird es oft als künstlicher Aromastoff anstelle des teureren Vanillins verwendet, da es zudem 2–4 mal intensiver in Geschmack und Aroma ist.[33]
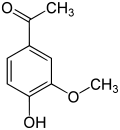
Acetovanillon (4-Hydroxy-3-methoxyacetophenon, auch Apocynin) ist gleichfalls ein struktureller Verwandter und unterscheidet sich vom Vanillin, indem man die Aldehydgruppe gegen eine Acetylgruppe austauscht. Es entsteht in künstlichen Vanille-Aromen auf Lignin-Basis.[5]
Vanillin und Ethylvanillin besitzen einen ähnlichen Geruch, der des Isovanillins ist hingegen kaum merkbar.[34] Vanillin und Ethylvanillin lassen sich mit Gemischen aus Hexan und Essigsäureethylester per Dünnschichtchromatographie gut trennen.[35]
Verwendung
Vanillin ist mengenmäßig der wichtigste Aromastoff weltweit, da er preisgünstig hergestellt werden kann. Man geht von einem Verbrauch von 15.000 Tonnen im Jahr aus (2004).[1] Die etwa 2.000 Tonnen Kapselfrüchte echter Vanille, die weltweit jährlich geerntet werden, enthalten nur etwa 40 Tonnen Vanillin.
Vanillin wird zum Beispiel als Beimengung zu Vanillinzucker (laut ISO-Norm 5565-2 v. 1999 beträgt der Vanillingehalt zwischen 1,6 und 2,4 %) verkauft und als Aromastoff in Lebensmitteln verwendet, unter anderem in Speiseeis, Backwaren und Schokolade. Daneben ist Vanillin einer von vielen Duftstoffen bei der Parfümherstellung und zur Geschmacksverbesserung von Pharmazeutika und Vitaminpräparaten, wo er in kleinen Mengen zur Abrundung und Fixierung von süßen, balsamischen Düften verwendet wird.
Auch in der chemischen Industrie wird Vanillin verwendet, beispielsweise als Ausgangsstoff oder Zwischenprodukt bei der Synthese von verschiedenen Arzneistoffen, wie beispielsweise Levodopa, Methyldopa und Papaverin. Es ist außerdem Bestandteil von Günzburgs Reagenz – einer alkoholischen Lösung von Phloroglucin und Vanillin zum qualitativen Nachweis der freien Salzsäure im Magensaft.[1]
Siehe auch
Einzelnachweise
- ↑ a b c d e f g h i j k l Römpp Lexikon Lebensmittelchemie, 2. Auflage, Georg Thieme Verlag, Stuttgart 2006, ISBN 978-3-13-143462-3, S. 1222–1223.
- ↑ a b c d e f g h Eintrag zu Vanillin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. August 2009 (JavaScript erforderlich).
- ↑ a b c d e CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Vanillin bei ChemIDplus.
- ↑ a b c d Lawrence J. Esposito, K. Formanek, G. Kientz, F. Mauger, V. Maureaux, G. Robert, F. Truchet: „Vanillin“, Kirk-Othmer Encyclopedia of Chemical Technology, 4th edition, Vol. 24, John Wiley & Sons, New York 1997, S. 812–825.
- ↑ N.-T. Gobley: „Recherches sur le principe odorant de la vanille“, in: Journal de Pharmacie et de Chimie, 1858, 34, S. 401–405 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Ferd. Tiemann, Wilh. Haarmann: „Ueber das Coniferin und seine Umwandlung in das aromatische Princip der Vanille“, in: Berichte der Deutschen Chemischen Gesellschaft, 1874, 7 (1), S. 608–623; doi:10.1002/cber.187400701193.
- ↑ K. Reimer: „Ueber eine neue Bildungsweise aromatischer Aldehyde“, in: Berichte der deutschen chemischen Gesellschaft, 1876, 9 (1), S. 423–424; doi:10.1002/cber.187600901134.
- ↑ Römpp CD 2006, Georg Thieme Verlag 2006.
- ↑ Nicholas J. Walton, Melinda J. Mayer, Arjan Narbad: „Vanillin“, in: Phytochemistry, 2003, 63 (5), S. 505–515; doi:10.1016/S0031-9422(03)00149-3.
- ↑ Manuel Brenes, Aranzazu García, Pedro García, José J. Rios, Antonio Garrido: „Phenolic Compounds in Spanish Olive Oils“, in: Journal of Agricultural and Food Chemistry, 1999, 47 (9), S. 3535–3540; doi:10.1021/jf990009o.
- ↑ Mohamed Adahchour, René J. J. Vreuls, Arnold van der Heijden, Udo A. Th. Brinkman: „Trace-level Determination of Polar Flavour Compounds in Butter by Solid-phase Extraction and Gas Chromatography-Mass Spectrometry“, in: Journal of Chromatography A, 1999, 844 (1–2), S. 295–305; doi:10.1016/S0021-9673(99)00351-9.
- ↑ Deborah D. Roberts, Terry E. Acree: „Effects of Heating and Cream Addition on Fresh Raspberry Aroma Using a Retronasal Aroma Simulator and Gas Chromatography Olfactometry“, in: Journal of Agricultural and Food Chemistry, 1996, 44 (12), S. 3919–3925; doi:10.1021/jf950701t.
- ↑ Peter K. C. Ong, Terry E. Acree: „Gas Chromatography/Olfactory Analysis of Lychee (Litchi chinesis Sonn.)“, in: Journal of Agricultural and Food Chemistry, 1998, 46 (6), S. 2282–2286; doi:10.1021/jf9801318.
- ↑ Carole Viriot, Augustin Scalbert, Catherine Lapierre, Michel Moutounet: „Ellagitannins and Lignins in Aging of Spirits in Oak Barrels“, in: Journal of Agricultural and Food Chemistry, 1993, 41 (11), S. 1872–1879; doi:10.1021/jf00035a013.
- ↑ Imre Blank, Alina Sen, Werner Grosch: „Potent Odorants of the Roasted Powder and Brew of Arabica Coffee“, in: Zeitschrift für Lebensmittel-Untersuchung und -Forschung A, 1992, 195 (3), S. 239–245; doi:10.1007/BF01202802.
- ↑ P. Semmelroch, G. Laskawy, I. Blank, W. Grosch: „Determination of Potent Odourants in Roasted Coffee by Stable Isotope Dilution Assays“, in: Flavour and Fragrance Journal, 1994, 10 (1), S. 1–7; doi:10.1002/ffj.2730100102.
- ↑ S. Kermasha, M. Goetghebeur, J. Dumont: „Determination of Phenolic Compound Profiles in Maple Products by High-Performance Liquid Chromatography“, in: Journal of Agricultural and Food Chemistry, 1995, 43 (3), S. 708–716; doi:10.1021/jf00051a028.
- ↑ Ron G. Buttery, Louisa C. Ling: „Volatile Flavor Components of Corn Tortillas and Related Products“, in: Journal of Agricultural and Food Chemistry, 1995, 43 (7), S. 1878–1882; doi:10.1021/jf00055a023.
- ↑ Helmut Guth, Werner Grosch: „Odorants of Extrusion Products of Oat Meal. Changes During Storage“, in: Zeitschrift für Lebensmittel-Untersuchung und -Forschung A, 1995, 196 (1), S. 22–28; doi:10.1007/BF01192979.
- ↑ Daphna Havkin-Frenkel, Andrzej Podstolki, Ewa Witkowska, Pjotr Molecki, Monika Mikolajczyk: Vanillin biosynthetic pathways: an overview, in: Tong-Jen Fu, Gurmeet Singh, Wayne R. Curtis: Plant Cell and Tissue Culture for the Production of Food Ingredients, American Chemical Society 1999. Division of Agricultural and Food Chemistry, S. 35–43 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Patent WO03071861: Vanillin Biosynthetic Pathway Enzyme from Vanilla planifolia. Veröffentlicht am 4. September 2003, Erfinder: Daphna Havkin-Frenkel, Andrzej Podstolski, Richard A. Dixon.
- ↑ Osamu Negishi, Kenji Sugiura, Yukiko Negishi: „Biosynthesis of Vanillin via Ferulic Acid in Vanilla planifolia“, in: Journal of Agricultural and Food Chemistry, 2009, 57 (21), S. 9956–9961; doi:10.1021/jf901204m; PMID 19817415.
- ↑ R. Debowska, A. Podstolski: „Properties of Diphenolase from Vanilla planifolia (Andr.) Shoot Primordia Cultured in Vitro“, in: Journal of Agricultural and Food Chemistry, 2001, 49 (7), S. 3432–3437; doi:10.1021/jf001180z; PMID 11453787.
- ↑ Martin B. Hocking: „Vanillin: Synthetic Flavoring from Spent Sulfite Liquor“, in: Journal of Chemical Education, 1997, 74 (9), S. 1055–1059; doi:10.1021/ed074p1055.
- ↑ a b Gary M. Lampman, Jennifer Andrews, Wayne Bratz, Otto Hanssen, Kenneth Kelley, Dana Perry, Anthony Ridgeway: „The Preparation of Vanillin from Eugenol and Sawdust“, in: Journal of Chemical Education, 1977, 54 (12), S. 776–778; doi:10.1021/ed054p776.
- ↑ a b c Beyer / Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 504.
- ↑ Douglass F. Taber, Shweta Patel, Travis M. Hambleton, Emma E. Winkel: „Vanillin Synthesis from 4-Hydroxybenzaldehyde“, in: Journal of Chemical Education, 2007, 84 (7), S. 1158; doi:10.1021/ed084p1158.
- ↑ H. Priefert, J. Rabenhorst, A. Steinbüchel: „Biotechnological Production of Vanillin“, in: Applied Microbiology and Biotechnology, 2001, 56, S. 296–314; doi:10.1007/s002530100687.
- ↑ Biotechnologische Produktion von Vanillin.
- ↑ Riechstofflexikon: Vanillin.
- ↑ Georgios I. Panoutsopoulos, Christine Beedham: „Enzymatic Oxidation of Vanillin, Isovanillin and Protocatechuic Aldehyde with Freshly Prepared Guinea Pig Liver Slices“, in: Cell. Physiol. Biochem., 2005, 15 (1–4), S. 89–98; PMID 15665519; PDF.
- ↑ Römpp Lexikon Lebensmittelchemie, 2. Auflage; Georg Thieme Verlag, Stuttgart 2006, ISBN 978-3-13-143462-3, S. 329.
- ↑ Toru Egawa, Akiyo Kameyama, Hiroshi Takeuchi: „Structural Determination of Vanillin, Isovanillin and Ethylvanillin by Means of Gas Electron Diffraction and Theoretical Calculations“, in: Journal of Molecular Structure, 2006, 794 (1–3), S. 92–102; doi:10.1016/j.molstruc.2006.01.042.
- ↑ A. V. Gerasimov, N. V. Gornova, N. V. Rudometova: „Determination of Vanillin and Ethylvanillin in Vanilla Flavorings by Planar (Thin-Layer) Chromatography“, in: Journal of Analytical Chemistry, 2003, 58 (7), S. 677–684; doi:10.1023/A:1024764205281.
Literatur
- Beilstein E IV 8, 1763.
- Alfons M. Burger: Die natürlichen und künstlichen Aromen, Hüthig-Verlag; Heidelberg 1968.
- Jean-Paul Vidal: „Vanillin“, in: Food and Feed Technology, Band 2, John Wiley & Sons, New York 2008, ISBN 978-0-470-17448-7, S. 526–538.
- Andrew J. Taylor, Robert Linforth: Food Flavour Technology, John Wiley & Sons, Oxford, ISBN 978-1-4051-8543-1, S. 170.
- Björn Bernhard Kuhse: Vanillin - Historie und Schulrelevanz, 1. Auflage, Cuvillier Verlag, Göttingen 2010, ISBN 978-3-8695-5459-4
Weblinks
- chemgapedia (Duftstoffe: Vanillin/Ethylvanillin als Beispiel): Teil 1, Teil 2
- Vanille aus Orchideen, Vanillin aus Holz (www.chemieunterricht.de)
- Simon Cotton (Uppingham School, Rutland, UK): Vanillin
- Vanillic aldehyde (wikigenes.org)

Dieser Artikel wurde am 13. November 2009 in dieser Version in die Liste der lesenswerten Artikel aufgenommen.
Wikimedia Foundation.