- Cytochrom
-
Cytochrome (auch: Zytochrome, griech. chroma = Farbe) sind farbige Proteine (Chromoproteine) (daher der Name, der „Zellfarbstoff“ bedeutet), die Häme als prosthetische Gruppe enthalten und Reduktionsäquivalente übertragen, indem das Eisenion im Häm die Oxidationszahl wechselt. Cytochrome werden nach der Variante des Häms, das sie enthalten und nach ihrem Licht-Absorptionsspektrum unterschieden.[1]
Sie spielen eine Rolle bei der Zellatmung, bei der Photosynthese und bei anderen biochemischen Vorgängen, wo sie als Überträger von Reduktionsäquivalenten bei Redoxreaktionen (Kofaktor von Oxidoreduktasen) wirken. Es gibt circa 50 verschiedene Typen. Cytochrome kommen in Zellorganellen wie Mitochondrien und Chloroplasten vor. Die biologische Funktion der Cytochrome besteht in der Elektronenübertragung. Außerdem kommen Cytochrome im braunen Fettgewebe vor. Die Cytochrome geben dabei – zusammen mit zahlreichen Gefäßen – dem Fettgewebe seine braune Farbe.[2]
Inhaltsverzeichnis
Geschichte
Die Cytochrome wurden 1884 von McMunn[3] entdeckt. Erst 40 Jahre nach der Entdeckung konnte David Keilin[4] die Spektren von lebenden Zellen interpretieren als die der drei wichtigsten Cytochrome a, b und c.[5][6]
Eigenschaften
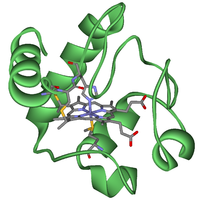
Cytochrome besitzen als prosthetische Gruppe ein oder mehrere Häm-Moleküle. Die Cytochrome unterscheiden sich im Häm-Typ und vom Apoprotein, welches das Häm umgibt. Nach ihren charakteristischen Licht-Absorptionsspektren unterscheidet man die Cytochrome a, b, c und d.
Beispiele
Das bestuntersuchte Cytochrom ist das Cytochrom c, welches aus dem Herzmuskelgewebe von Thunfischen oder Pferden gewonnen wird. Es besteht aus ungefähr 100 Aminosäuren und die molekulare Struktur ist durch Proteinkristallographie gut charakterisiert. Cytochrom c ist evolutionsgeschichtlich ein sehr altes Protein.
Im Gegensatz zu vielen anderen Cytochromen, die Aufgaben beim Elektronentransport wahrnehmen, katalysiert das Cytochrom P450 die Hydroxylierung nichtaktivierter Kohlenwasserstoffe.
Weitere Cytochrome:
- Cytochrom c Reduktase
- Cytochrom c Oxidase
- Cytochrom c Peroxidase
- Cytochrom P450 Oxidase
- Cyclooxygenase
- Cytochrom b6/f-Komplex
Literatur
- ↑ MeSH: Cytochromes
- ↑ Audrey Ensminger (Hrsg.): Foods & Nutrition Encyclopedia. Edition: 2, CRC Press, 1994, p. 1638. ISBN 0849389801
- ↑ McMunn, C. A. (1884): On myohaematin, an intrinsic muscle-pigment of vertebrates and invertebrates, on histohaematin, and on the spectrum of the suprarenal bodies. In: Proceedings of the Physiological Society. Bd. 5, S. XXIV-XXVI. PMC
- ↑ Keilin, D. (1925): On cytochrome, a respiratory pigment, common to animals, yeast, and higher plants. In: Proceedings of the Royal Society of London. Series B. Bd. 98, S. 312-339. JSTOR
- ↑ Margoliash, E. & Schejter, A (1984): 100 and 70 years ago: Myohaematins and histohaematins (cytochromes). In: Trends Biochem. Sci. Bd. 9, S. 364–367. doi:10.1016/0968-0004(84)90062-8
- ↑ Slater, E.C. (2003): Keilin, cytochrome, and the respiratory chain. In: J. Biol. Chem. Bd. 278, S. 16455-16461. PMID 12560322 doi:10.1074/jbc.X200011200
Siehe auch
Weblinks
- Internationale Normenklatur der Cytochrome (IUBMB) (englisch)
- PROMISE Datenbank: Cytochrome (englisch)
Wikimedia Foundation.