- GAPDH
-
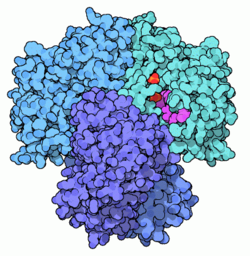
Glyceraldehyd-3-Phosphat-Dehydrogenase GAPDH (Blautöne) mit Sulfat (orange/rot) und NAD (lila) nach PDB 3GPD Vorhandene Strukturdaten: 1j0x, 1u8f, 1znq, 2feh, 3gpd Größe 334 aa; 35,9 kDa Struktur Homotetramer Kofaktor PRKCI, Sulfat Bezeichner Gen-Namen GAPDH; GAPD Externe IDs OMIM: 138400 UniProt: P04406 MGI: 3646088 Enzymklassifikation EC, Kategorie 1.2.1.12 Oxidoreduktase Reaktionsart Phosphorylierung Substrat D-Glyceraldehyd-3-phosphat + Phosphat + NAD(+) Produkte 3-Phospho-D-glyceroylphosphat + NADH Vorkommen Homologie-Familie HBG269967 Übergeordnetes Taxon Lebewesen Orthologe Mensch Huhn Entrez 2597 374193 Ensembl ENSG00000111640 ENSGALG00000014442 UniProt P04406 P00356 Refseq (mRNA) NM_002046 NM_204305 Refseq (Protein) NP_002037 NP_989636 Genlocus Chr 12: 6.51 - 6.52 Mb Chr 1: 80.09 - 80.09 Mb PubMed Suche [1] [2] Die Glycerinaldehyd-3-phosphat-Dehydrogenase (GAPDH) ist ein Enzym der Glycolyse und daher unentbehrlich für alle Lebewesen. Sie katalysiert die Umwandlung von Glycerinaldehyd-3-Phosphat zu 1,3-Bisphosphoglycerat. Bei dieser Reaktion wird eine energiereiche Phosphat-Bindung aufgebaut, die im folgenden Schritt der Glycolyse auf ADP übertragen wird wodurch ATP entsteht. Außerdem wird in der katalysierten Reaktion ein NAD+ zu NADH/H+ umgewandelt.
Inhaltsverzeichnis
Katalytischer Mechanismus
Das Hauptproblem der Reaktion stellt die Abspaltung des H--Ion (Hydridion) von der Aldehydgruppe des Glycerinaldehyd-3-Phosphats dar. Dies ist energetisch ungünstig, da der Kohlenstoff in der Aldehydgruppe eine positive Partialladung trägt. Durch die kovalente Bindung einer Sulfhydrylgruppe eines Cysteins des Enzyms wird ein nukleophiler Rest eingeführt. Dadurch löst sich das Hydridion und zwischen Enzym und Substrat entsteht ein Thioester. Diese energiereiche Verbindung wird in der nachfolgenden Reaktion benutzt um ein organisches Phosphat zu binden und das Zwischenprodukt in 1,3-Bisphosphoglycerat umzuwandeln. Das Hydridion bindet mittlerweile an ein kovalent gebundenes NAD+, so dass NADH/H+entsteht. Dieses löst sich aus der Bindung mit dem Enzym und wird durch ein NAD+ ersetzt um den ursprünglichen Zustand wiederherzustellen.[1]
Die katalysierte Reaktion nimmt energetisch einen hohen Stellenwert ein. Das entstandene gemischte Anhydrid aus Phosphor- und Carbonsäure wird in der nachfolgenden Reaktion zur ATP-Bildung verwendet. Aus dem NADH/H+ kann wiederum ATP in der Atmungskette gebildet werden.[2]
Hemmung
Die Bildung des energiereichen Anhydrids und von NADH+/H+ ist durch Arsen hemmbar. AsO43- bindet dabei analog zum Phosphat an die GAPDH. Die Bindung zwischen dem Substrat und Arsenat ist jedoch sehr instabil, so dass dieses zu 3-Phosphoglycerat zerfällt. Dadurch wird ein energiefixierender Schritt in der Glykolyse übersprungen, was zur Giftwirkung des Arsens beiträgt.[3]
Quellen
- ↑ Stryer, Lubert : Biochemie, Spektrum der Wissenschaft Verlag, 4. Auflage, Heidelberg, 1996 S.526
- ↑ Florian Horn et al. : Biochemie des Menschen, Stuttgart 2003, ISBN 3-13-130883-4, S.80,
- ↑ Stryer, Lubert : Biochemie, Spektrum der Wissenschaft Verlag, 4. Auflage, Heidelberg, 1996 S.527
Weblinks
Wikimedia Foundation.