- Cystein
-
Strukturformel 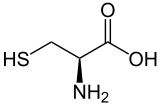
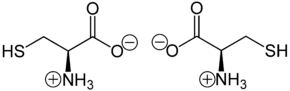
L-Cystein (links) und D-Cystein (rechts) Allgemeines Name Cystein Andere Namen - (R)-2-Amino-3-mercapto-propansäure
- IUPAC: 2-Amino-3-sulfanylpropansäure (ohne Stereochemie)
- (R)-Thioserin
- α-Amino-β-mercaptopropionsäure
- Abkürzungen:
- Cys (Dreibuchstabencode)
- C (Einbuchstabencode)
Summenformel C3H7NO2S CAS-Nummer - 52-90-4 (L-Enantiomer)
- 921-01-7 (D-Enantiomer)
- 52-89-1 (L-Cystein·Hydrochlorid)
- 3374-22-9 (DL-Cystein)
- 207121-46-8 (D-Cystein·Hydrochlorid·Monohydrat)
PubChem 5862 DrugBank DB00151 Kurzbeschreibung farbloser Feststoff mit charakteristischem Geruch [1]
Eigenschaften Molare Masse 121,16 g·mol−1 Aggregatzustand fest
Schmelzpunkt 220–228 °C [1]
pKs-Wert - pKCOOH: 1,71
- pKNH2: 10,78
- pKSeitenkette: 8,27 (je bei 25 °C)[2]
Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 
Achtung
H- und P-Sätze H: 302 EUH: keine EUH-Sätze P: keine P-Sätze [1] EU-Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22 S: keine S-Sätze LD50 1890 mg·kg−1 (Ratte, oral) [1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Cystein (ausgesprochen: Cyste-ín), abgekürzt Cys oder C, ist eine schwefelhaltige proteinogene α-Aminosäure mit der Seitenkette –CH2–SH, die beim Erwachsenen in der Leber gebildet werden kann. Cystein kann in den enantiomeren Formen D und L vorliegen, wobei in Proteinen nur die L-Form [Synonym: (R)-Cystein] enthalten ist. Da Schwefel nach der CIP-Nomenklatur eine höhere Priorität als Sauerstoff hat, ist L-Cystein – neben dem Disulfid L-Cystin – und L-Selenocystein die einzige proteinogene Aminosäure mit (R)-Konfiguration.
In diesem Artikel betreffen die Angaben zur Physiologie allein das L-Cystein. Wenn in diesem Artikel und in der wissenschaftlichen Literatur ohne jeden Zusatz „Cystein“ erwähnt wird, ist stets L-Cystein gemeint. Das racemische DL-Cystein [Synonym: (RS)-Cystein] und enantiomerenreines D-Cystein [Synonym: (S)-Cystein] sind synthetisch zugänglich und besitzen nur geringe praktische Bedeutung. Die Racemisierung von L-Aminosäuren kann zur Aminosäuredatierung – einer Altersbestimmung für fossiles Knochenmaterial – herangezogen werden.[4]
L-Cystein wurde zuerst aus Nierensteinen isoliert, woraus sich auch der Name (gr. κύστις: Harnblase) ableitet.
Zwei Cysteinreste können eine Disulfidbrücke ausbilden, wobei Cystin entsteht. Disulfidbrücken sind neben Wasserstoffbrückenbindungen, ionischen Bindungen und Van-der-Waals-Kräften für die Bildung und den Erhalt der Tertiär- und Quartärstruktur von Proteinen verantwortlich.
Inhaltsverzeichnis
Vorkommen
Ein Protein mit hohem L-Cystein-Gehalt ist Keratin (z. B. Haare, Borsten, Hörner).
Lebensmittel
Die folgenden Beispiele geben einen Überblick über Cysteingehalte und beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil von Cystein am Gesamtprotein angegeben.[5]
Lebensmittel Gesamtprotein Cystein Anteil Schweinefleisch, roh 20,95 g 242 mg 1,2 % Hähnchenbrustfilet, roh 21,23 g 222 mg 1,0 % Lachs, roh 20,42 g 219 mg 1,1 % Hühnerei 12,57 g 272 mg 2,2 % Kuhmilch, 3,7 % Fett 3,28 g 30 mg 0,9 % Sonnenblumenkerne 20,78 g 451 mg 2,2 % Walnüsse 15,23 g 208 mg 1,4 % Weizen-Vollkornmehl 13,70 g 317 mg 2,3 % Mais-Vollkornmehl 6,93 g 125 mg 1,8 % Reis, ungeschält 7,94 g 96 mg 1,2 % Sojabohnen, getrocknet 36,49 g 655 mg 1,8 % Erbsen, getrocknet 24,55 g 373 mg 1,5 % Cystein zählt zu den nichtessentiellen Aminosäuren. Zumindest für Erwachsene gilt es als gesichert, dass der Körper den gesamten Bedarf an Cystein auch aus der essentiellen Aminosäure Methionin synthetisieren kann, sofern die Nahrung genug davon enthält. Ob Cystein seinerseits imstande ist, einen Teil des Methionins zu ersetzen, ist noch Gegenstand der Forschung. Manchmal werden Cystein und Methionin unter dem Begriff schwefelhaltige Aminosäuren zusammengefasst und ein gemeinsamer Bedarf angegeben. Zu beachten ist, dass es sich dabei aber nicht um einen echten kombinierten Bedarf, sondern lediglich um den Methioninbedarf bei cysteinfreier Kost handelt.[6]
→ Zahlenwerte siehe Hauptartikel Methionin
Oftmals werden in der Literatur und den Nährstoffdatenbanken bei der Angabe des Cysteingehaltes die Begriffe Cystein und Cystin synonym verwendet. Im strengen Sinne ist das nicht korrekt, da Cystein das Monomer und Cystin das durch eine Schwefelbrücke entstandene Dimer bezeichnet. Viele gängige Analysemethoden quantifizieren die beiden Verbindungen aber nicht getrennt.[7]
Biochemische Bedeutung
Vielfältige Funktionen des Cysteins im Organismus leiten sich aus der relativen Reaktivität seiner Thiolgruppe ab. So kann sich bei der Proteinfaltung zwischen Cysteinresten, die sich in verschiedenen Polypeptidketten oder an verschiedenen Stellen ein und derselben Polypeptidkette befinden und durch die Faltung in räumliche Nähe geraten, eine Disulfidbrücke (–S–S–) ausbilden. Der Vorgang wird von der Protein-Disulfid-Isomerase[8] reguliert. Die kovalente Bindung erhöht die Stabilität der Proteinstruktur und kommt bei vielen extrazellulären Proteinen vor, beispielsweise bei Keratin und Insulin. Weiterhin ist zu erwähnen, dass eine größere Gruppe von Enzymen von Cysteinresten koordinierte Eisen-Schwefel-Cluster besitzt. Die relativ reaktive Thiolgruppe des Cysteins kann aber auch direkt am katalytischen Mechanismus beteiligt sein, wie bei der Glycerinaldehyd-3-phosphat-Dehydrogenase, wo Cystein das Substrat am aktiven Zentrum bindet. [9]
Cystein ist außerdem ein Ausgangsstoff bei der Biosynthese von Verbindungen wie Glutathion, Coenzym A und Taurin.[10]
Eigenschaften
Cystein liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe an das einsame Elektronenpaar des Stickstoffatoms der Aminogruppe wandert:
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert) der Fall, bei dem das Cystein auch seine geringste Löslichkeit in Wasser hat. Der isoelektrische Punkt von Cystein liegt bei einem pH-Wert von 5,02.[11]
Cystein könnte zu den nicht essentiellen Aminosäuren gezählt werden, da es vom Körper gebildet werden kann. Allerdings ist dazu die essentielle Aminosäure Methionin erforderlich. Daher wird Cystein üblicherweise als semiessentiell betrachtet. Als Bestandteil vieler Proteine und Enzyme ist es oft am Katalysemechanismus beteiligt.
In neutraler bis alkalischer wäßriger Lösung erfolgt bei Luftzutritt eine Oxydation zu Cystin.[3] Bei der Einwirkung stärkerer Oxidationsmittel wird die Cysteinsäure gebildet.[3]
Technische Gewinnung
L-Cystein kann, wie fast alle anderen Aminosäuren, durch Einwirkung von Salzsäure auf Proteine wie Keratin (meist aus keratinreichen Geweben wie Menschen- oder Tierhaaren oder Federn) durch Hydrolyse gewonnen werden. Seit einiger Zeit ist die Darstellung auch durch Fermentation mit Bakterien, z. B. Escherichia coli, auch unter Einsatz gentechnisch veränderter Organismen möglich (siehe Darstellung Tryptophan). Racemisches Cystein (DL-Cystein) kann vollsynthetisch aus 2-Chloracetaldehyd, Natriumhydrogensulfid, Ammoniak und Aceton über das nach der Asinger-Reaktion gewonnene Zwischenprodukt 2,2-Dimethyl-3-thiazolin gewonnen werden. Anschließend wird Blausäure angelagert und sauer hydrolysiert. [12]
Biosynthese und Metabolismus
Cystein wird biosynthetisch aus Serin, welches das Grundgerüst liefert, und Methionin über Homocystein, das die SH-Gruppe beiträgt, in der Leber gebildet. Dazu sind die Enzyme Cystathionin-Synthetase und Cystathionase erforderlich. Serin-oder Methioninmangel hemmen folglich die Cysteinsynthese.
Die Aminosäure kann durch α,β-Eliminierung abgebaut werden. Dabei entstehen Aminoacrylat und Schwefelwasserstoff (H2S). H2S wird zum Sulfat (SO42−) oxidiert. Aminoacrylat isomerisiert zum Iminopropionat, das hydrolytisch seine Aminogruppe abspaltet und so zum Pyruvat wird.
Durch Transaminierung kann es auch zum β-Mercaptopyruvat werden. Die Sulfit-Transferase überträgt Sulfit auf die Thiolgruppe und wandelt diese dadurch in ein Thiosulfat um. Nach Hydrolyse der Kohlenstoff-Schwefel-Bindung wird anschließend Pyruvat frei; das Thiosulfat (S2O32−) wird zum Sulfat oxidiert. Cystein kann auch an der SH-Gruppe oxidiert werden und anschließend zum Taurin decarboxylieren.
Durch genetisch bedingte Defekte im Cystintransporter kann nach Aufnahme im Magen-Darm-Trakt und Wiederaufnahme in der Niere eine Cystinurie entstehen. Die Mutation im rBAT-Gen betrifft auch den Stoffwechsel der Aminosäuren Lysin, Arginin und Ornithin, also die Polyamino-Aminosäuren.
Therapeutische Funktionen
Aus L-Cystein werden pharmazeutische Wirkstoffe im industriellen Maßstab hergestellt, z. B. (R)-S-Carboxymethylcystein und (R)-N-Acetylcystein (ACC bzw. NAC). Diese beiden Pharmawirkstoffe sollen als orale Mukolytika den oft zähen Bronchialschleim bei chronischer Bronchitis und chronisch obstruktiver Lungenerkrankung verflüssigen. Unter der Gabe von Cystein wird der im Verlauf dieser Erkrankungen vermehrt gebildete Bronchialschleim dünnflüssiger und kann so leichter abgehustet werden. Cystein steigert auch eine Reihe von Lymphozytenfunktionen, wie beispielsweise die zytotoxische T-Zellaktivität. Cystein und Glutathion verhindern die Expression von NF-AT, des nukleären Transkriptionsfaktors in stimulierten T-Zell-Linien. In-vitro-Studien zeigen, dass die stimulierende Wirkung von TNF (Tumornekrosefaktor), induziert durch freie Radikale, auf die HIV-Replikation in Monozyten durch schwefelhaltige Antioxidantien gehemmt werden kann. Diese grundlegenden Studien sprechen dafür, dass die Behandlung von Entzündungskrankheiten und AIDS mit Cystein damit möglicherweise nützlich sein könnten.
Cystein kann Schwermetall-Ionen komplexieren. Sie wird daher unter anderem als Therapeutikum für Silber-Vergiftungen eingesetzt. Da es freie Radikale an die Thiolgruppe bindet, wird Cystein auch zur Vorbeugung von Strahlenschäden eingesetzt. Bei Feten, Früh- und Neugeborenen, sowie bei Leberzirrhose ist die Aktivität des Enzyms Cystathionase nicht vorhanden oder stark eingeschränkt. In diesen Fällen ist eine exogene Cysteinzufuhr notwendig.[13] Es ist ein Radikalfänger, der die zellschädigenden Stoffe unschädlich macht und für den in neueren Studien eine gewisse Vorbeugefunktion gegen neurodegenerative Erkrankungen postuliert wird.
Bei der sehr seltenen Neurodegeneration mit Eisenablagerung im Gehirn bewirkt eine Mutation im für das Enzym Pantothenatkinase kodierende PANK2-Gen, dass es zu einer Anreicherung von Cystein-Eisen-Komplexen im Gehirn – speziell im Globus pallidus und der Substantia nigra pars reticulata – kommt. Dies führt wiederum zu einem Anstieg freier Radikale und letztlich zu einer oxidativen Schädigung der Nervenzellen des Gehirns.[14]
Bestandteil von Aminosäure-Infusionslösungen zur parenteralen Ernährung.[15]
Lebensmittelzusatzstoff
Cystein wird als Mehlbehandlungsmittel eingesetzt. Es trägt zur beschleunigten Mehlreifung bei, was insbesondere bei automatisierten Backvorgängen, beispielsweise für Kekse, von großer Bedeutung ist. Es wird Teigen aus stark glutenhaltigen (kleberstarken) Mehlen beigegeben, da es die Klebereigenschaften von Mehl verändert, indem es den Dehnwiederstand durch Reduktion von Disulfidbrücken der Kleberproteine herabsetzt.[16] Daneben wird Cystein bei Diätzubereitungen, Futtermittel, Arzneimitteln und Kosmetika eingesetzt. Ferner ist es ein Grundstoff zur Aromaerzeugung, insbesondere für Fleisch- und Röstaromen. Als semiessentielle Aminosäure wird Cystein/Cystin adaptierter Muttermilch zugesetzt. L-Cystein ist in der EU als Lebensmittelzusatzstoff (E 920) ohne Höchstmengenbeschränkung (quantum satis) für Lebensmittel als Mehlbehandlungsmittel zugelassen. Eine Deklaration in fertigen Produkten ist nicht erforderlich.
Weitere Anwendungsgebiete
In japanischen Friseursalons ersetzt Cystein, das Disulfidbindungen im Keratin aufzubrechen vermag, die in Europa übliche, streng riechende Thioglycolsäure, wenn es darum geht, Haare für Dauerwellen zu präparieren. Auch in anderen Kosmetikprodukten wird Cystein verwendet.
Einzelnachweise
- ↑ a b c d e f g Datenblatt Cystein bei Merck, abgerufen am 7. Januar 2008.
- ↑ Hans-Dieter Jakubke und Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim 1982, ISBN 3-527-25892-2, S. 40.
- ↑ a b c Thieme Römpp Online, abgerufen am 21. Juli 2011.
- ↑ Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, 62, 1982, ISBN 3-527-25892-2.
- ↑ Nährstoffdatenbank des US-Landwirtschaftsministeriums, 22. Ausgabe.
- ↑ R. O. Ball, G. Courtney-Martin, P. B. Pencharz: The in vivo sparing of methionine by cysteine in sulfur amino acid requirements in animal models and adult humans. In: J. Nutr. 136(6 Suppl); June 2006: S. 1682S–1693S PMID 16702340 (freier Volltextzugriff).
- ↑ M. Aristoy, F. Toldra: Amino Acids. In: L. M. L. Nollet (Hrg.): Handbook of Food Analysis. 2. Auflage. Marcel Dekker AG, New York, Basel 2004; S. 95, 110; ISBN 0-8247-5036-5.
- ↑ Eintrag EC 5.3.4.1 in der Enzymdatenbank BRENDA.
- ↑ J. M. Berg, J. L. Tymoczko, L. Stryer: Biochemie. 6. Auflage. Spektrum Akademischer Verlag, Elsevier GmbH, München 2007; S. 38f, 48, 494f, 570; ISBN 978-3-8274-1800-5.
- ↑ D. Doenecke, J. Koolman, G. Fuchs, W. Gerok: Karlsons Biochemie und Pathobiochemie. 15. Auflage. Georg Thieme Verlag, Stuttgart 2005; S. 41, 208, 219 ISBN 978-3-13-357815-8.
- ↑ P. M. Hardy: The Protein Amino Acids in G. C. Barrett (Herausgeber): Chemistry and Biochemistry of the Amino Acids, Chapman and Hall, 1985, ISBN 0-412-23410-6, S. 9.
- ↑ Jürgen Martens, Heribert Offermanns und Paul Scherberich: Eine einfache Synthese von racemischem Cystein, Angewandte Chemie 93 (1981) 680 doi:10.1002/ange.19810930808; Angewandte Chemie International Edition English 20 (1981) 668. doi:10.1002/anie.198106681.
- ↑ P. Fürst, H.-K. Biesalki u. a.: Ernährungsmedizin. Thieme-Verlag, Stuttgart 2004, ISBN 3-13-100293-X S. 94.
- ↑ B. Zhou u. a.: A novel pantothenate kinase gene (PANK2) is defective in Hallervorden-Spatz syndrome. In: Nature Genetics 28, 2001, S. 345-349. PMID 11479594.
- ↑ S. Ebel und H. J. Roth (Herausgeber): Lexikon der Pharmazie, Georg Thieme Verlag, 1987, S. 66, ISBN 3-13-672201-9.
- ↑ Thieme Chemistry (Hrsg.): Eintrag zu Mehlverbesserung im Römpp Online. Version 3.14. Georg Thieme Verlag, Stuttgart 2011, abgerufen am 7. Juli 2011.
Weblinks
- Web-Special von Wacker-Chemie zu Cystein
 Proteinogene Aminosäuren
Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Hydroxylysin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
Wikimedia Foundation.